多糖作为一类重要的天然大分子化合物,具有增强免疫功能,抗肿瘤、抗衰老等作用。中药活性多糖作为免疫调节剂有着良好的应用前景[1]。熟地黄为玄参科植物地黄(rehmannia glutionosa libosch)的干燥茎经炮制而成,是滋阴补血药[2],临床上广泛用于阴虚、血虚所致的各种病症[3]。为探讨熟地黄中的活性成分作用,本实验从熟地黄中提取出熟地多糖,采用苯酚-硫酸分光光度法测定其多糖含量,并对灌服熟地多糖的小鼠免疫应答水平进行了检测。
1 材料与方法 1.1 仪器与试剂UV-754分光光度计(上海第三分析仪器厂);酶标仪(美国Organon Teknika公司)。0.9%氯化钠注射液(四川科伦大药厂),批号:A000586.08;D-葡萄糖(AR,105℃干燥至恒重),其他试剂均为分析纯。小鼠IL-2 ELISA测定试剂盒(美国TPI公司)。
1.2 药材熟地黄(大连国药大药房)经大连药品检验所鉴定为生地黄的根炮制而成。
1.3 动物昆明种小鼠,雄性,体重18~22 g(大连医科大学动物中心),合格证号:SCXK(辽)2002-0002。
1.4 抗原制备20%绵羊红细胞(SRBC)抗原制备:将抗凝绵羊血用生理盐水洗涤3次,取压积SRBC 20 ml,加生理盐水至100 ml;卵清蛋白抗原的制备:取市售鸡蛋,将壳击碎后取卵清1:5倍稀释备用。
1.5 方法 1.5.1 熟地多糖的提取与精制[4]称取已干燥的熟地黄250 g,加入适量80%乙醇过夜,回流提取3 h脱脂,药渣挥尽乙醇后,沸水提取2次,每次2 h,合并提取液,浓缩至200 ml,加95%乙醇使醇含量达到80%,于4℃冰箱中醇沉过夜。抽滤,滤渣依次用无水乙醇、丙酮洗涤,得到粗多糖。将粗多糖溶于水,用Sevage法除蛋白,反复进行3次至无蛋白。流水透析后,蒸发浓缩至200 ml,加95%乙醇使醇含量达到80%,于4℃冰箱中醇沉过夜。抽滤,滤渣依次用无水乙醇、丙酮洗涤,真空干燥。
1.5.2 熟地多糖的含量分析(1) 标准系列溶液的配制:精密称取105℃干燥至恒重的葡萄糖标准品20 mg,蒸馏水溶解后,定容至100 ml。精确移取此溶液1.0,2.0,4.0,5.0,6.0,7.5 ml,分别置于50 ml容量瓶中,稀释至刻度:摇匀,配成系列标准溶液。(2)5%苯酚溶液的配制:取分析纯苯酚200 ml,蒸馏收集182℃馏分,准确称取12.5 g苯酚馏分,加水稀释至250 ml溶液,置棕色瓶内,放4℃冰箱中备用。(3)标准曲线的绘制:分别准确移取1 ml系列标准溶液于具塞试管中,以1 m1蒸馏水作空白,每管加入1 ml 5%苯酚溶液,再垂直快速加入浓H2SO4,摇匀,放置5 min,沸水加热15 min,之后用流水速冷至室温,于490 nm处测定吸光度(A)值。(4)换算因子的测定:精密称取熟地多糖20 mg,溶于50 ml容量瓶中,稀释至刻度,摇匀。精密吸取此溶液1 ml于具塞试管中,按照1.5.2(3)项的方法测定吸光度,根据回归方程计算多糖溶液中葡萄糖的浓度,按公式计算出换算因子f:f=W/C·D。式中:W为多糖质量(mg),C为多精浓度(mg/ml),D为稀释因素。(5)样品溶液的制备:精密称取熟地黄1.0 g,加入150 ml 80%乙醇回流提取3 h,滤渣挥尽乙醇后,用100 ml水提取2 h,2次,定容至250 ml,作为样品液。(6)精密度实验:称取熟地黄5份,每份1.0 g,按1.5.2(5)项方法制备样品液,按1.5.2(3)项方法测定。(7)稳定性实验:取样品液1 ml,按1.5.2(3)项方法测定吸光度,每隔1 h测定1次,连续8 h,考察其稳定性。(8)回收实验:精密称取5份熟地黄1.0 g,分别加入40 mg的熟地多糖,按照1.5.2(5)项制备样品溶液和1.5.2(3)项方法测定,测得吸光度(A)值,计算回收率。(9)样品中多糖含量的测定精密吸取1.5.2(5)项中的样品溶液1 ml于具塞试管中,按照1.5.2.3项的方法测定吸光度,由回归方程计算样品液中葡萄糖浓度,按公式计算样品中多糖的含量(%)=(C·D·f/W)×100%。式中:C为样品液中葡萄糖的浓度,D为稀释因素,f为换算因子,W为样品质量。
1.5.3 熟地多糖免疫活性分析(1) 小鼠分组:取小鼠96只,随机分为8组,每组12只,即熟地多糖高(1,5组)、中(2,6组)、低(3,7组)剂量实验组及对照组(4,8组)。实验组剂量为50,100,200 mg/kg,对照组为生理盐水。进行第1次免疫,第1,2,3,4组注射20% SRBC抗原,第5,6,7,8组注射卵清蛋白抗原,剂量为每只鼠0,2 ml,注射部位为腹股沟。注射抗原后的第3 d开始给药,1,2,3,5,6,7组小鼠灌胃给予漏芦多糖,4,8组小鼠灌胃给予生理盐水,剂量均为每只0.5 ml,各组均每天1次,连续7 d。第8 d进行第2次加强免疫(方法同第1次免疫),继续灌胃服药,1周后,小鼠断头采血,分离血清备检。(2)SRBC抗体测定:采用定量微量血凝法[5]。(3)卵清蛋白抗体测定:采用酶联免疫吸附试验(ELISA)[5]。以卵清蛋白包被酶标板,测定相应抗体,以吸光值A表示抗体水平。(4)白细胞介素-2(IL-2)测定[6]:采用小鼠IL-2 ELISA试剂盒测定。待测血清按1:10稀释。IL-2检测结果经酶标仪450 nm波长测定A值,根据标准品A值绘制标准曲线,以μg/K为单位,计算其含量。
1.6 统计分析采用SPSS 8.0统计软件进行方差分析。
2 结果 2.1 熟地多糖的提取率水提醇沉法制得熟地多糖8.83 g,提取率为3.53%。
2.2 熟地多糖含量分析 2.2.1 葡萄糖标准曲线回归方程A=8.08×10-3C+0.003 3,r=0.999 8,线性范围为5~40 μg/ml。
2.2.2 换算因子的测定f=2.72(n=6)。
2.2.3 精密度实验相对标准偏差(RSD)为2.08%(n=5),表明分析方法精密度良好。
2.2.4 稳定性实验吸光度在8 h内无明显变化,RSD为1.13%。
2.2.5 回收率实验测得回收率分别为99.45%,97.32%,98.69%,97.80%,99.39%,平均回收率为98.53%,RSD为2.28%。
2.2.6 样品中多糖含量的测定测得多糖含量为1.35%,1.50%,1.42%,1.31%,1.67%(n=5),多糖平均含量为1.45%,RSD为1.54%。
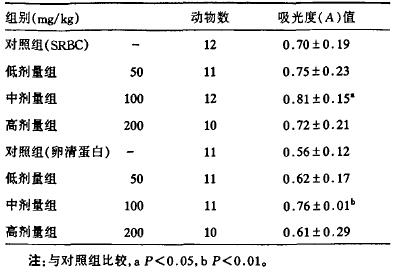
2.3 抗体效价测定结果(表 1)与对照组小鼠比较,中剂量实验组SRBC抗体效价明显增高,差异有统计学意义(P<0.05);中剂量实验组卵清蛋白抗体效价明显增高,差异有统计学意义(P<0.01)。表明熟地多糖可以提高应激态小鼠的体液免疫水平。
| 表 1 地多糖对小鼠SRBC和卵清蛋白抗体水平的影响(x±s) |
2.4 小鼠细胞因子IL-2生成水平
中剂量给药组SRBC和卵清蛋白抗体增强。对照组的小鼠(0.74±0.13)μg/L,而给药组为(2.25±0.63)μg/L,细胞因子IL-2生成水平明显增高(P<0.05)。表明熟地多糖可以提高应激态小鼠的细胞免疫水平。
3 讨论本实验从熟地黄中提取出熟地多糖,用苯酚-硫酸分光光度法测定其多糖含量。实验表明,此方法简便、稳定、重现性良好,便于实际应用,可作为多糖质控的主要指标之一。熟地多糖对小鼠免疫实验结果表明,灌服中剂量熟地多糖的小鼠免疫应答水平高于对照组。而低、高剂量熟地多糖对小鼠的免疫应答水平差异无统计学意义,表明熟地多糖对小鼠免疫应答水平呈现出剂量依赖性。同时小鼠受SRBC抗原激发后,IL-2水平明显升高。表明熟地多糖可作用于IL-2分泌细胞,促使细胞分泌IL-2的数量增多或活性增强,调整机体的免疫应答,也是熟地多糖对机体免疫有增强作用途径之一。本研究未采用免疫低下小鼠模型,即得到熟地多糖提高小鼠免疫水平的结果,表明熟地多糖具有较强的免疫调节作用,可增强机体的免疫功能,是一种具有良好开发前景的免疫调节剂。
| [1] | 刘颖, 金宏, 程义勇. 多糖生物活性及其作用机制研究进展[J]. 中国公共卫生, 2006, 22(5) : 627–629. |
| [2] | 国家药典委员会.中华人民共和国药典[s].一部.北京:化学工业出版社.2005:82-83. http://d.wanfangdata.com.cn/Reference.aspx?id=Periodical_zjzyxyxb200702040&title=%e7%99%8c%e7%97%9b%e8%83%b6%e5%9b%8a%e4%b8%ad%e4%ba%ba%e5%8f%82%e7%9a%82%e8%8b%b7Rb1%e5%90%ab%e9%87%8f%e7%9a%84%e6%b5%8b%e5%ae%9a |
| [3] | 卢瑞萍. 地黄药理作用及临床应用研究进展[J]. 海峡药学, 2004, 16(3) : 23. |
| [4] | 方积年. 多糖的分离纯化及某纯度鉴别与分子量测定[J]. 药学通报, 1981, 19(10) : 622–625. |
| [5] | 刘辉. 研究生免疫学教程[M]. 2000: 306-308. |
| [6] | 李发胜.杨光, 咸丰, 等. 漏芦多塘对小鼠激发态免疫功能的影响及其可能机制[J]. 中国中药杂志, 2007, 32(5) : 433–435. |
 2008, Vol. 24
2008, Vol. 24