单核细胞增生李斯特菌(L monocytogenes,LM)的主要检测手段是细菌分离、血清学检测、ELISA技术、基因探针技术、PCR方法等[1, 2]。其中,PCR检测方法比传统方法更具有优越性,但不同的PCR方法在模板制备、靶基因选择、方法特异性和灵敏度方面存在较大差异,缺少统一的检测标准。本研究将近年来报道的单个PCR[3]、套式PCR[4]、多重PCR[5-7]等3种快速检测方法进行比较,以期为实际应用提供依据。
1 材料与方法 1.1 材料(1) 菌株:单核细胞增生李斯特菌标准株EGD、无毒李斯特菌L.innocua(德国维尔茨堡微生物系Goebel教授惠赠);枯草芽胞杆菌B.subtilis 168(中科院武汉病毒所汤显春老师惠赠)。(2)试剂:脑心浸液培养基(BHI,美国Difco公司);琼脂粉及蛋白胨(大连TaKaRa公司);酵母提取物(英国OXOID LTD公司);琼脂糖(美国Promega 公司);基因组DNA提取试剂盒(上海赛百盛基因技术有限公司);Taq 酶及DNA标准分子量 (广州东胜生物科技有限公司);其他常用试剂均为国产或进口分析纯。(3)仪器:PCR扩增仪、5415D高速离心机(德国Eppendorf公司);Gene Genius凝胶成像系统(美国SYN GENE公司);DYY-6B稳压稳流电泳仪(北京六一仪器厂)。
1.2 方法 1.2.1 菌种培养从平板上挑取单个菌落,单核细胞增生李斯特菌标准株和无毒李斯特菌,分别接种到灭菌的脑心浸液培养基(BHI,Brain Heart Infusion)培养基,枯草芽胞杆菌接种到脂质双层(LB)培养基,37 ℃摇床过夜培养。
1.2.2 引物设计根据GeneBank上提供的EGD全基因组序列,针对单核细胞增生李斯特菌标准株(EGD)的毒力及毒力相关基因iap和prfA分别设计引物用于单个、多重及套式PCR检测。所有引物均由上海赛百盛基因技术有限公司合成。细菌(EGD)靶基因iap引物共3组,引物Iap-for:5′-AAACTGCTAACACAGCTACTC-3′,引物Iap-rev:5′-GCACTTGAATTGCTGTTATTG-3′,产物长度为370bp;引物lsf-for:5′-CAAGCACTGTAGTAGTCGAAG-3′,引物lsf-rev:5′-TTGTAGTGCTAGCGTATTGTG-3′,产物长度为1192bp;引物lsi-for:5′-CTACACAAGCAACTACACCTG-3′,引物lsi-rev:5′-GTTTGTAGATGGTGCAGGAG-3′,产物长度为407bp;细菌EGD靶基因prfA引物1组,引物PrfA-for:5′-AGCTCACGAGTATTAGCGAG-3′,引物PrfA-rev:5′-TCCCCAAGTAGCAGGACATG-3′,产物长度为563bp。
1.2.3 PCR模板制备取过夜培养的菌液及10倍梯度稀释的菌液1.5 ml,按试剂盒说明提取基因组DNA作为PCR模板。
1.2.4 3种PCR方法反应体系优化根据设计引物并结合文献[3-8],对3种PCR的反应体系进行优化。(1)单个PCR反应体系:10×Taq buffer 5 μl,10mmol/L dNTPs 2 μl,100 pmol/L引物各0.5 μl,基因组DNA 10 μl,Taq酶0.5 μl,用ddH2O加至50 μl体系。PCR反应条件为:94 ℃预变性3 min,94 ℃变性1 min,51 ℃退火1 min,72 ℃延伸1 min,30个循环,72 ℃总延伸10 min。(2)套式第1次PCR反应体系及反应条件与单个PCR相同;套式第2次PCR反应体系:10×Taq buffer 5 μl,10 mmol/L dNTPs 2 μl,100 pmol/L引物各0.5 μl,DNA模板(套式第1次PCR产物)3 μl,Taq酶0.5 μl,用ddH2O加至50 μl体系。PCR反应条件为:94 ℃预变性3 min,94 ℃变性1min,52 ℃退火1 min,72 ℃延伸1 min,30个循环,72 ℃总延伸10 min。(3)多重PCR的反应体系:10×Taq buffer 5 μl,10 mmol/L dNTPs 3 μl,100 pmol/L引物各1 μl,基因组DNA 15 μl,Taq酶1 μl,用ddH2O加至50 μl体系。反应条件与单个PCR相同。3种PCR产物用1.5%的琼脂糖凝胶进行电泳分析,置凝胶成像系统检测电泳结果并拍照。
1.2.5 灵敏度与特异性分析(1) 灵敏度:分别取10倍梯度稀释的菌液1.5 ml制备PCR模板;同时,取相应稀释度菌液各200 μl进行平板菌落计数。各稀释度至少重复3次,取其平均值测定PCR方法灵敏度。(2)特异性:按1.2.4的PCR反应条件对单核细胞增生李斯特菌EGD、无毒李斯特菌L.innocua和枯草芽胞杆菌B.subtilis 168等3种细菌进行检测方法的特异性分析。
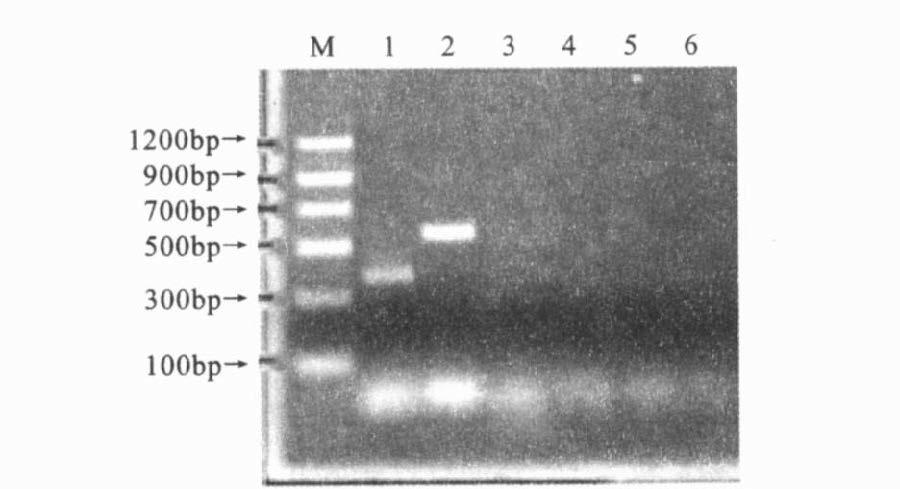
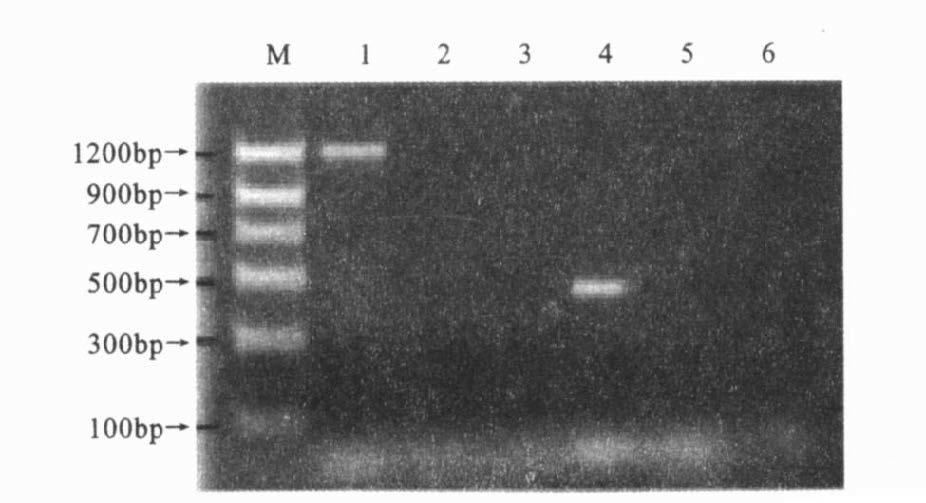
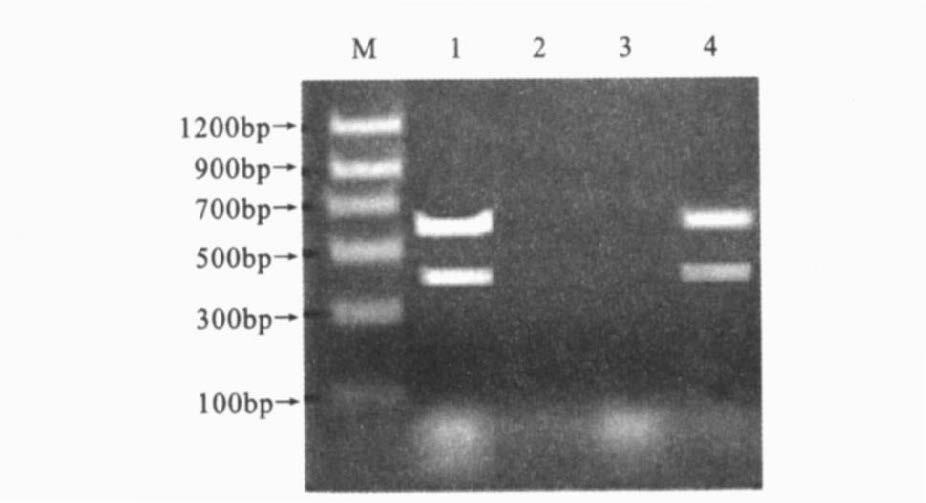
2 结 果 2.1 特异性比较(图 1)3种PCR方法的电泳结果显示,均只有单核细胞增生李斯特菌EGD有特异性条带,而无毒李斯特菌和枯草芽孢杆菌均没有扩增产物,表明3种PCR方法检测单核细胞增生李斯特菌均具有很好的特异性。
|
注:M:DNA 标准分子量;1,2 :单核细胞增生李斯特菌标准株;3,4:无毒李斯特菌;5,6 :枯草芽孢杆菌。1,3,5 :引物均为Iap-for/ rev ;2,4,6 :引物均为PrfA - for/ rev。 图 1 单个PCR特异性检测 |
|
注:M:DNA 标准分子量;1~3 :依次为单核细胞增生李斯特菌标准株、无毒李斯特菌、枯草芽孢杆菌,引物均为lsf-for/rev;4~6:套式第1 次产物(即1、2、3 号孔中的PCR 产物) ;引物均为lsi-for/ rev。 图 2 套式PCR特异性检测 |
|
注:M:DNA 标准分子量;1 :单核细胞增生李斯特菌标准株,2 :无毒李斯特菌;3 :枯草芽孢杆菌,4 :3 种菌株的混合物;引物均为Iap - for/rev 和PrfA - for/ rev。 图 3 多重PCR特异性检测 |
2.2 灵敏度比较
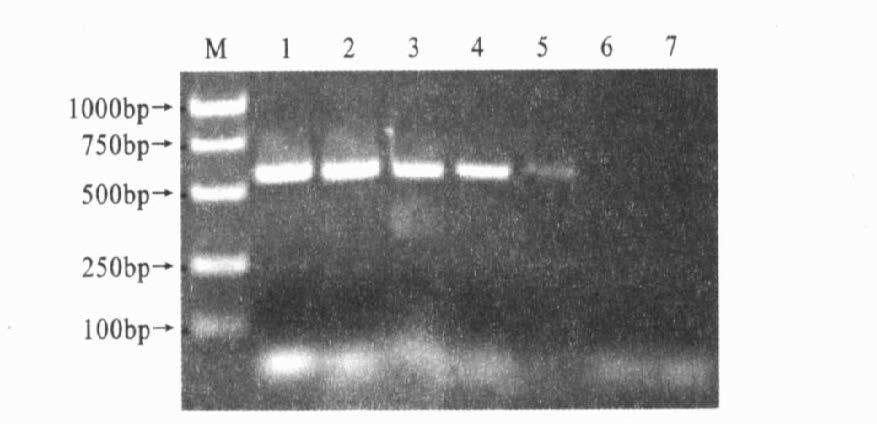
(1) 单个PCR:以prfA-for/rev为引物,在稀释度<10-5,即菌液浓度为103 cfu/ml,可检出与预期长度一致的扩增条带,而在稀释度为10-6以下,则不能检测出目标带(图 4)。(2)套式PCR:套式第1次扩增灵敏度可达到104 cfu/ml(即菌液稀释度<10-4时,可检出预期长度的扩增产物);第1次套式PCR产物经进行第2次套式PCR扩增后,灵敏度可高达102 cfu/ml(即稀释度为10-5)(图 5)。(3)多重PCR:在稀释度<10-4,即菌液浓度相当于104 cfu/ml时,均能得到2条目标带。而在稀释度为10-5以后,则不能检出目标带。说明多重PCR灵敏度104 cfu/ml(图 6)。
|
注:M:DNA标准分子量;EGD稀释度依次为1:10-1;2:10-2;3:10-3;4:10-4;5:10-5;6:10-6;7:10-7;引物均为PrfA-for/rev。 图 4 单个PCR灵敏度检测 |
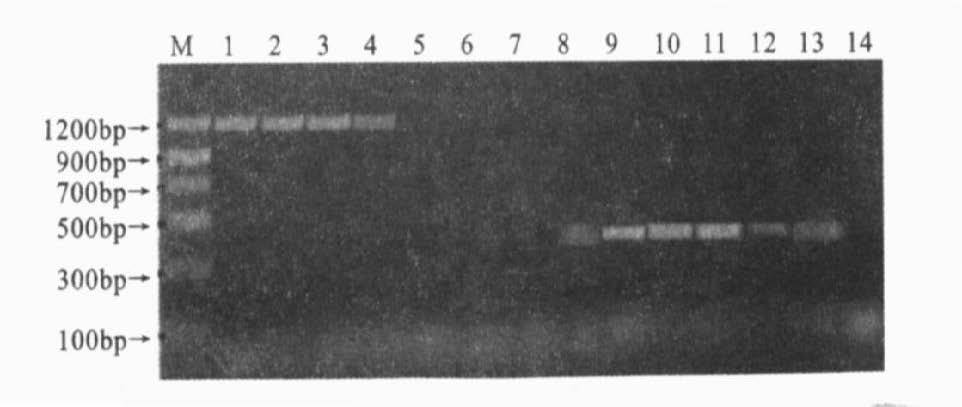
|
注:M:DNA 标准分子量;EGD 稀释度依次为10-1~10-7 ,引物均为lsf-for/ rev;8~14:为套式第1 次的PCR 产物(即1~7号);引物均为lsi-for/rev。 图 5 套式PCR灵敏度检测 |
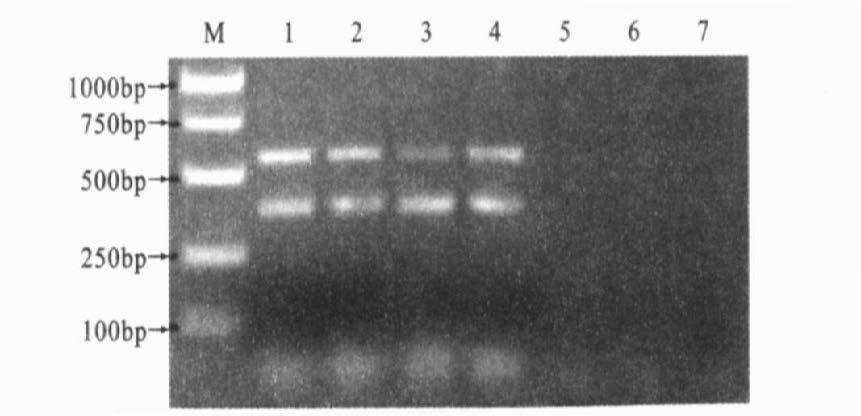
|
注:M:DNA 标准分子量;1~7:EGD稀释度依次为1:10-1;2:10-2;3:10-3;4:10-4;5:10-5;6:10-6;7:10-7; 引物均为Iap - for/ rev 和prfA - for/ rev。 图 6 多重PCR灵敏度检测 |
3 讨论
本研究结果表明,prfA基因和iap基因[9, 10]一样,在PCR检验中具有极好的特异性和灵敏度。3种PCR方法均具有较好的特异性,表明利用单核细胞增生李斯特菌的毒力基因和毒力调控基因设计引物,能够区分致病性单核细胞增生李斯特菌和无毒李斯特菌,可用于食品检测部门对食品的安全监督工作。灵敏度检测结果表明,单个PCR的检测极限为103 cfu/ml,套式PCR为102 cfu/ml,多重PCR为104 cfu/ml。套式PCR比多重PCR的灵敏度高100倍,比单个PCR高10倍,显示出套式PCR在检测灵敏度方面的优势。综合比较3种PCR的效果可见,多重PCR在特异性检测方面具有优势,而在灵敏度检测方面,套式PCR要明显优于单个及多重PCR方法。基层卫生检疫部门应该根据自身的条件,结合检测监督工作的目的选择适合的PCR方法。
| [1] | 白竟玉,付萍,李志刚.食品卫生微生物学检验-单核细胞增生李斯特氏菌检验[S].GB4789.30-2003.北京:中国标准出版社,2004. |
| [2] | 刘桂华, 乔凤, 黄鑫, 等. 食品中单增李斯特菌PCR检测方法建立与评价[J]. 中国公共卫生, 2007, 23(1) : 60–61. |
| [3] | 徐琴, 巢国强, 周晓辉, 等. PCR法检测单核细胞增生李斯特菌[J]. 中国公共卫生, 2004, 20(11) : 1387–1388. |
| [4] | 马宝华, 张辉华, 吕平, 等. 李斯特菌套式PCR快速检测方法的建立及初步应用[J]. 动物医学进展, 2005, 26(11) : 57–60. |
| [5] | 冯家望, 吴小伦, 王小玉, 等. 多重-巢式PCR检测食品中单增李斯特菌研究[J]. 中国国境卫生检疫, 2007, 2(30) : 56–59. |
| [6] | 张晓峰, 李爱云, 方维焕, 等. 多重聚合酶链反应鉴别单核细胞增生李斯特菌的研究[J]. 中华检验医学杂志, 2003, 2(26) : 93–95. |
| [7] | 杨平, 杨迎伍, 陈伟, 等. 食品中4种致病微生物的多重PCR快速检测技术研究[J]. 西南大学学报:自然科学版, 2007, 29(5) : 90–94. |
| [8] | 王海燕, 刘中学, 刘虹, 等. 食品中单增李斯特菌快速、敏感、特异PCR检验方法的建立[J]. 检验检疫科学, 2006, 1(14) : 3–6. |
| [9] | O'Connor L. Detection of Listeria monocytogenes using a PCR/DNA probe assay[J]. Methods Mol Biol, 2003, 216 : 185–192. |
| [10] | 许业莉, 相大鹏, 蔡颖. 食源性致病微生物中应用于PCR 检测的靶基因[J]. 检验检疫科学, 2003, 13(6) : 52–54. |
 2008, Vol. 24
2008, Vol. 24

