2. 山东大学齐鲁医院骨创科;
3. 山东省立医院脊柱外科;
4. 山东省疾病预防控制中心
后纵韧带骨化(ossification of the posterior longitudinal ligamentof the spine,OPLL)是一种常见病,是脊柱韧带的异位成骨,常导致脊髓压迫和严重的脊髓病[1],其发病机制仍未清楚。Inamasu J[2]认为,后纵韧带骨化是多因素导致发病,其中包括遗传和环境的相互作用。骨形态发生蛋白(BM Ps)可在非骨组织中诱导新的软骨和骨形成[3],参与了OPLL 的发生[4]。本研究检测BMP-2 在后纵韧带组织中的表达和人重组骨形态发生蛋白-2(r hBMP-2)对OPLL 和非OPLL 细胞系分化方向的影响,旨在探讨OPLL 的发病机制。
1 对象与方法 1.1 对象山东大学第二医院及齐鲁医院骨科OPLL 患者共15 例,年龄23~ 78 岁,其中男性9 例,女性6 例。
1.2 方法 1.2.1 主要试剂和仪器rhBMP-2(北京邦定泰克生物技术有限公司); 骨钙素测定试剂盒(北京东亚免疫技术研究所); 链酶亲和素-生物素-过氧化物酶复合物试剂盒、二氨基联苯胺试剂盒(武汉博士德生物公司); 抗BMP-2 单克隆抗体(北京中山生物技术有限公司); LS-3801 型全自动C闪烁计数仪(美国Beckman 公司)。
1.2.2 标本来源 OPLL组标本取自OPLL 患者颈前路后纵韧带切除术中所得到的非骨化部位的后纵韧带,对照组标本取自术前影像学检查未发现骨化的脊髓型颈椎病或颈椎外伤患者手术中切除的脊柱韧带。
1.2.3 脊柱韧带细胞的分离和培养收集第3 代以后的细胞用于实验。共建立8 个OPLL 细胞系(OL1~ OL8)及7 个非OPLL 细胞系(NL1~ NL7)。
1.2.4 培养细胞的刺激细胞长满培养板后,在分别含有10,100,250,500 ng/ ml 的rhBMP-2 培养液中培养,并设立不含r hBMP-2 的对照组。每组设3 个复孔。
1.2.5 ALP 活性的测定细胞裂解后,与底物(71 5 mmol/ L对硝基酚酯,50 mmol/ L T ris-HCl,pH= 91 6,1 mmol/ L MgCl2)在37 e 共同孵育15 min。分光光度计测A 值(波长405nm),然后换算成ALP 活性,以每ml 上清液中含有的ALP 单位数(U/ ml)表示。
1.2.6 DNA 及胶原合成量的测定细胞在含有刺激因子的培养液中培养94 h 后,加入3H-胸腺嘧啶核苷(3H-TdR)/ 3H-脯氨酸(终浓度为1 LCi/ L),继续培养2 h。终止培养后,细胞用磷酸盐缓冲液(PBS)洗涤2 次,再用胰蛋白酶消化,收集细胞于玻璃纤维滤纸上,依次用PBS、5% 三氯醋酸和无水乙醇洗涤细胞各3 次,烘干,在C闪烁计数仪上测定每分钟计数。
1.2.7 骨钙素合成量的测定收集不同时间段的培养液100 Ll,125 I 标记的骨钙素100 Ll 与骨钙素抗体100 Ll 混合后置24 h,加分离剂1 ml 混匀后室温下放置15 min,以3 500r / min于4 e 离心20 min,弃上清,检测沉淀物的放射剂量(设空白对照组及实验对照组),由自动C计数仪预先编制程序,直接测出相关参数、标准曲线及样品浓度,以ng/ ml 表示。
1.2.8 后纵韧带组织的免疫组织化学染色标本切取后用生理盐水冲洗2 次,10%中性甲醛固定10~ 15 min,常规脱水、浸蜡、包埋,切片,按试剂盒说明进行SABC 法染色。细胞浆内有棕黄色颗粒者为阳性细胞。
1.3 统计分析采用SPSS 131 0 软件进行单因素方差分析。
2 结 果 2.1 培养细胞的显微镜观察未经刺激的OL 及NL 细胞系中,OL1、OL3、OL7、OL8 细胞系细胞形态以多角形为主,呈分层生长,细胞内可观察到黑色颗粒和透亮小泡,并逐渐形成不透亮的小结节,结节逐步融合扩大。OL2、OL4、OL5、OL6和NL 细胞系细胞的形态以长梭形为主,呈放射状分布,细胞内分泌颗粒少,无分泌结节,呈成纤维细胞的表型。在BMP-2 刺激时,OL1、OL3、OL7、OL8 细胞系的多角形细胞增多;OL2、OL6 细胞系细胞形态由长梭形向多角形转变,出现分泌颗粒,细胞呈重叠交织性多层结构并有结节形成(图 1); OL4、OL5 细胞系细胞无变化。NL4、NL6 细胞系细胞由长梭形向多角形转变,出现较多的分泌颗粒,无明显的重叠交织性结构及结节形成,其余5 组NL 细胞系细胞无变化。
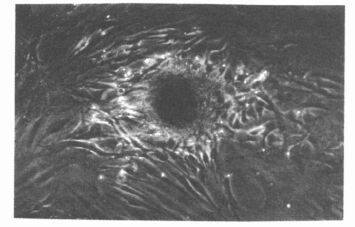
|
图 1 后纵韧带骨化组的黑色分泌结节(×200) |
2.2 rhBMP-2 对ALP 活性的影响
未用rhBMP-2 刺激时,4个OL 细胞系细胞ALP 活性较高(OL1: 11 09 U/ ml; OL3:0193 U/ ml; OL7: 1179 U/ ml; OL8: 1106 U/ ml),2 个OL 细胞系细胞ALP 活性较低(OL2: 01 57 U/ ml; OL6: 01 53 U/ ml),而所有NL 细胞系细胞的ALP 活性均较低,平均值为(01 46 ?0106)U/ ml。经rhBMP-2 刺激后,OL1、OL3、OL7 和OL8 细胞系细胞的ALP 活性明显增加,在250 ng/ ml 的rhBMP-2 刺激条件下,OL3 和OL8 细胞系细胞的ALP 最大值分别是对照组的1186 倍和1146 倍,在500 ng/ ml 的rhBMP-2 刺激条件下,OL1 和OL7 细胞系细胞ALP 活性最大值分别是对照组的11 77 倍和11 82 倍,与对照组比较,差异有统计学意义(P<0.05)。而在NL 细胞系中,只有NL4、NL6 细胞系细胞的ALP 活性明显增强(P<0.05)。
2.3 rhBMP-2 对3H-TdR 掺入量的影响rhBMP-2 明显增加了OL1、OL2、OL3、OL5、OL8 细胞系细胞DNA 的3H-TdR掺入量,其中OL3 细胞系细胞DNA 的3H-TdR 掺入量是剂量依赖性的,其峰值是对照组的510 倍,OL1 的峰值是对照组的214 倍,OL2 的峰值是对照组的116 倍,OL5 的峰值是对照组的115 倍,OL8 的峰值是对照组的21 0 倍,与对照组比较,差异均有统计学意义(P<0.05)。NL 细胞系细胞在rhBMP-2刺激下,NL2、NL4、NL6 DNA 的3H-T dR 掺入量明显增加。
2.4 rhBMP-2 对3H-脯氨酸掺入量的影响OL1、OL2、OL6、OL7、OL8 细胞系细胞对rhBMP-2 的刺激产生反应,且其DNA 的3H-脯氨酸掺入量明显增加: OL1 的峰值为对照组的1195 倍,OL2 的峰值为对照组的11 93 倍,OL6 的峰值为对照组的2165 倍,OL7 的峰值为对照组的11 82 倍,OL8 的峰值为对照组的1151 倍,与对照组比较,差异均有统计学意义(P<0.05)。在7 个NL 细胞系细胞中仅有NL2、NL4、NL6 DNA的3H-脯氨酸掺入量明显增加(P<0.05)。
2.5 rhBMP-2 对骨钙素分泌的影响未经rhBMP-2 刺激时OL1、OL3、OL7 及OL8 细胞系细胞分泌骨钙素,经rhBMP-2刺激后,这4 组细胞系细胞的骨钙素水平均较对照组明显升高(P<0.05); OL2 和OL4 细胞系细胞出现骨钙素分泌,NL细胞系细胞中仅有NL4、NL6 测到骨钙素的分泌,但其分泌水平较低。
2.6 免疫组织化学染色结果BMP-2 在退变的后纵韧带、软骨化及骨化的后纵韧带组织中均有表达,而在正常后纵韧带中无表达。
3 讨 论BMPs 作为成骨诱导因子,可刺激多潜能基质干细胞分化为成骨细胞,并能增强成骨细胞的功能[5]。BMP-2 不仅在后纵韧带骨化的发生中起着重要作用,而且BMP-2 在后纵韧带骨化发生的各个阶段中均起作用。OPLL 组患者和非OPLL组患者的细胞经BMP-2 刺激后,反应细胞功能的ALP活性、骨钙素分泌、DNA 及胶原合成这4 个指标变化不同,这提示不同的后纵韧带骨化患者的后纵韧带中含有不同的细胞系,具有各种成骨细胞特性,细胞的这种异质性导致对BMP-2 刺激产生不同的反应。另一方面,极少数正常脊柱韧带细胞也可对BMP-2 的刺激产生反应并转化为成骨细胞。本研究还表明,后纵韧带骨化患者的韧带细胞较非后纵韧带骨化患者的韧带细胞更易对BMP-2 的刺激产生反应,提示BMP-2诱导后纵韧带骨化患者的后纵韧带细胞的BMP 受体(BMPR)表达和/ 或信号传导有别于正常脊柱韧带细胞,已有学者在细胞因子水平和基因水平进行研究[6]。
| [1] | Matsunaga S, Kukita M, Hayashi K, et al. Pathogenesis of myelopathy in pat ient s w ith ossification of th e posterior longitudinal ligament[J]. J Neurosurg, 2002, 96(2 Suppl) : 168–172. |
| [2] | Inamasu J, Guiot BH, Sachs DC. Ossificat ion of the post erior long-i tudinal ligament: an update on its biology, epidemiology, an d natural hist ory[J]. Neurosurgery, 2006, 58(6) : 1027–1039. DOI:10.1227/01.NEU.0000215867.87770.73 |
| [3] | Kaihara S, Bessho K, Okubo Y, et al. Over expression of bone morphogenet ic protein-3b (BMP-3b) using an adenoviral vector promote the ost eoblastic dif ferent iation in C2C12 cells and augment th e bone format ion induced by bon e morphogenetic prot ein-2 (BM P-2) in rat s[J]. L if e Sci, 2003, 72(15) : 1683–1693. |
| [4] | Sato R, U chida K, Kobayashi S, et al. Ossification of the post erior longitudinal ligament of the cervical spine: hist opathological f indings around the calcification and ossificat ion front[J]. Journal of Neurosurg Spine, 2007, 7(2) : 174–183. DOI:10.3171/SPI-07/08/174 |
| [5] | Luu HH, Song WX, Luo X, et al. Distinct roles of bone morphogenetic proteins in ost eogenic dif ferent iat ion of mesenchymal stem cells[J]. Journal of Orthopaedic Research, 2007, 25(5) : 665–677. DOI:10.1002/(ISSN)1554-527X |
| [6] | Horikoshi T, M aeda K, Kaw aguchi Y, et al. A large-scale genet ic associat ion study of ossif icat ion of the post erior longitudinal ligament of the spine[J]. Human Genetics, 2006, 119(6) : 611–616. DOI:10.1007/s00439-006-0170-9 |
 2008, Vol. 24
2008, Vol. 24

 , 张佐伦3, 林琳4
, 张佐伦3, 林琳4