2. 南华大学公共卫生学院劳动卫生与环境卫生教研室;
3. 中南大学湘雅医学院
甲基叔丁基醚(MTBE)为异丁烯和甲醇化合而成的无色透明液体,具有较强的挥发性。作为新型汽油添加剂,可提高汽油燃烧率,减少机动车辆尾气CO及其他有害物质的排放,并替代四乙基铅作为汽油抗爆剂[1]。研究表明,MTBE对动物不同组织、器官、系统具有一定的急、亚慢、慢性毒作用。MTBE对中枢神经系统具有明显的抑制毒性作用,但其作用机制尚不清楚。本实验用MTBE对大鼠进行急性染毒,观察MTBE对大脑皮质神经递质Fos蛋白、Na+,K+-ATP酶、Ca2+-ATP酶、神经元、神经胶质细胞的影响,探讨MTBE对中枢神经系统的急性毒作用机制。
1 材料与方法 1.1 试剂与仪器MTBE(湖南长岭煤油厂),纯度为98.7%。I抗为兔抗鼠Fos、胶质原纤维酸性蛋白(GFAP)多克隆抗体(美国Sigma公司)。II抗为生物化羊抗兔、小牛血清(北京中山生物有限公司)。生物素-卵白素-辣根过氧化物酶复合物(ABC液)(美国Sigma公司)。Motic Images Advanced 3.2型图像分析系统(美国Motic公司)。恒低温切片机(美国Therdo electron 公司)。ATP酶试剂盒(南京建成生物工程研究所);可见分光光度计WFJ2100型(上海尤尼柯仪器有限公司);低温高速离心机KA-1000型(上海安亭科学仪器厂)。
1.2 动物实验分组成年SD大鼠(中南大学实验动物部)66只,体重180~220 g,雌雄各半,随机分为8组。MTBE染毒途径为原液腹腔注射,染毒浓度为700,1 050,1 400 mg/(kg·bw)3个实验组;1 050 mg/(kg·bw)MTBE染毒组按染毒后不同时间(0.5,1.0,2.0,4.0,8.0 h)设5个实验组,另设1个对照组,注射等量生理盐水。其中对照组和1.0,8.0 h组各12只,其余每组6只。
1.3 免疫组织化学法采用生物素-卵白素-辣根过氧化物酶复合物法(ABC)在大鼠腹腔注射10%水合氯醛[0.2 ml/(50 g·bw)]处理,迅速开胸,经升主动脉灌注生理水50 ml后灌4%多聚甲醛(0.1 mol/L磷酸盐缓冲液,pH=7.4) 150~200 ml。取小脑置于上述固定液中固定2~4 h,再浸于15%和30%蔗糖磷酸缓冲液中至标本下沉。连续冠状冰冻切片,片厚30 μm。按免疫组织化学(ABC)法试剂盒方法进行操作。阴性对照采用0.01 mol/L磷酸盐缓冲液代替一抗,其余步骤相同。判断标准为Fos蛋白定位于胞核,胞核染为棕黄色为阳性。
1.4 尼氏(Nissl)染色Nissl液配制:0.5 g焦油紫加50 ml双蒸水溶解后配成A液;1 g醋酸钠加50 ml双蒸水溶解后加1.5 ml冰醋酸配成B液;然后取B液450 ml加至A液后过滤即为1%Nissl液。染色主要过程如下:(1) 切片用0.01 mol/L PBS(pH-7.4) 漂洗3次,每次5 min;(2) 贴片自然晾干;(3) 二甲苯浸泡10 min,2次;(4) 梯度酒精(100%,95%,85%,70%)各5 min;(5) 1%Nissl液染色;镜下观察至背景几乎无染色,而神经元染色界限清晰;(6) 自来水冲洗后,梯度酒精(70%,85%,95%,100%)各5 min,其中100%酒精2次;(7) 二甲苯浸泡10 min,2次;(8) 中性树胶封片观察。
1.5 显微照相及图像分析每只大鼠各取8张染色切片,每个部位取2张切片,在相同条件下,用Images Advanced 3.2图像采集系统采集图像并进行分析,测定观察部位的灰度平均值(灰度即图像的深浅程度,系统数字化图像的范围为0~255。阳性反应产物越深,灰度值越小,而相对灰度越大)。各组之间取同侧相同部位的相对灰度平均值进行比较。
1.6 脑皮质和酶的制备各组大鼠脱臼处死,冰上取出脑组织并分离大脑皮质,将大脑皮质放入预冷(4℃)的生理盐水中漂洗,除去血液,滤纸擦干,称取约0.5 g大脑皮质用于匀浆。考马斯亮兰法测定脑皮质蛋白含量,应用分光光度法测定Na+,K+ -ATP酶、Ca2+ -ATP酶,脑皮质与反应液体积比为1:2,总体积200 μl,37℃下酶反应30 min,冷却至室温,3 000~4 000 r/min离心10 min,取上清液200 μl定磷。酶活力单位以每小时每毫克组织蛋白(mgprot)产生的无机磷(Pi)含量(μmol)来表示,即μmol pi/(mg prot.h)。
1.7 统计分析采用SPSS 13.0软件进行统计学分析。各组比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 MTBE对大脑皮质Fos蛋白影响 2.1.1 不同剂量MTBE对大脑皮质Fos蛋白表达影响(表 1)| 表 1 不同剂量MTBE对大脑皮质Fos蛋白的影响(n= 6, 相对灰度值,x ± s) |
免疫组织化学结果显示:随着MTBE浓度的增加,Fos蛋白相对灰度平均值逐渐升高,与对照组比较差异有统计学意义。
2.1.2 MTBE染毒后不同时间对大脑皮质Fos蛋白表达变化(表 2)| 表 2 不同MTBE染毒时间对大脑皮质Fos蛋白影响(n= 6, 相对灰度值,x ± s) |
SD大鼠经MTBE 1 050mg/(kg·bw)染毒后不同时间大脑皮质Fos蛋白结果显示:染毒后0.5 h Fos蛋白表达即刻增强,其阳性神经元明显增多,胞核着色加深,相对灰度平均值增高;染毒后1.0 h达到高峰,Fos阳性神经元表达最多,胞核着色最深,相对灰度平均值最大;随后在染毒后2.0 h时Fos阳性神经元减少,胞核着色变浅,相对灰度平均值变小,至染毒后8.0h Fos蛋白的表达降至正常水平(图 1) 。MTBE染毒后0.5~4.0 h与对照组比较,Fos蛋白含量相对灰度平均值差异有统计学意义(P<0.01) ,染毒后8.0 h与对照组比较,Fos蛋白含量相对灰度平均值差异无统计学意义(P>0.05) 。
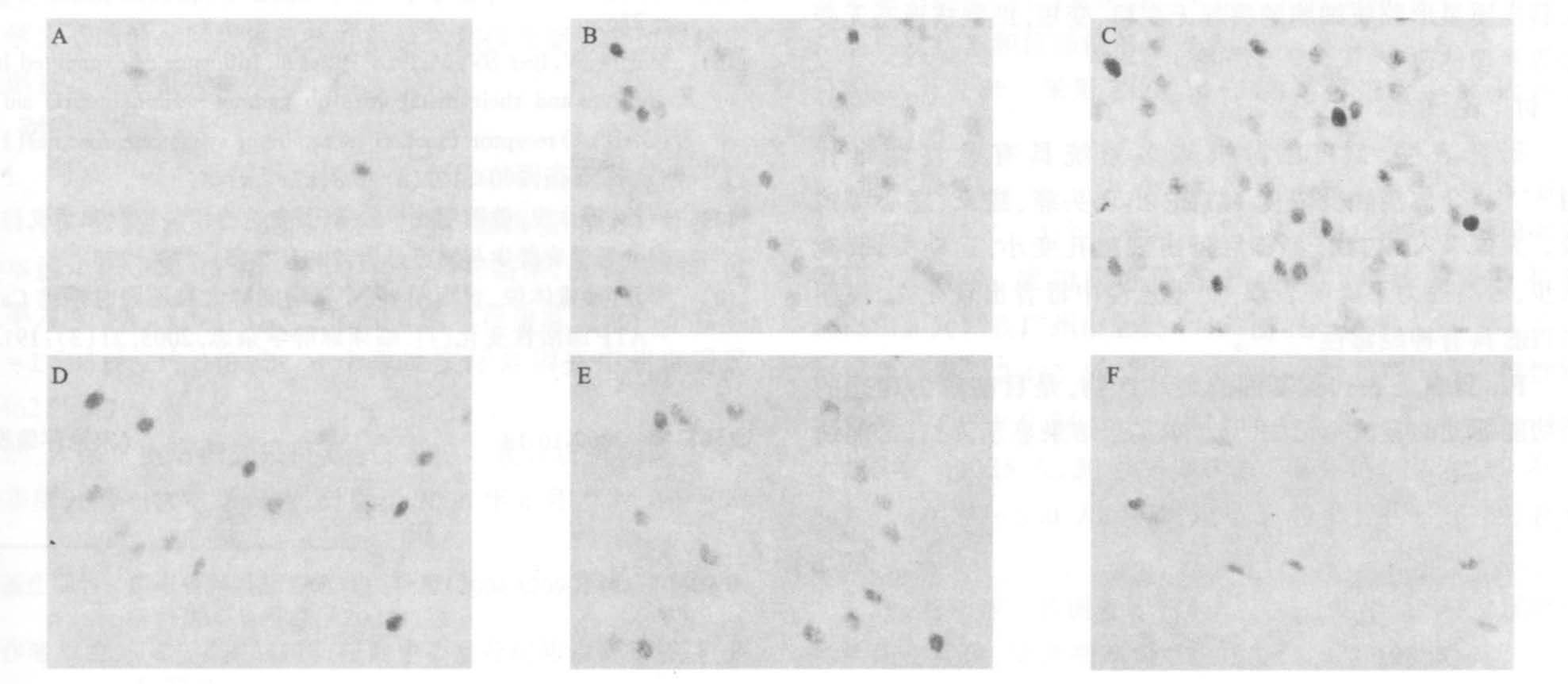
|
注: A: oh ; B: 0.5 h; C: 1.0 h; D: 2.0 h; E: 4.0 h; F: 8.0 h。 图 1 MTBE 染毒后不同时间对大脑皮质Fos 蛋白的影响( × 400) |
2.2 MTBE对大脑皮质ATP酶活性的作用(表 3)
| 表 3 MTBE染毒后不同时间对大脑皮质Na+,K+-ATP、Ca2+-ATP酶活性影响[(n= 6,x ± s,μmol pi/ ( mg prot. h))] |
大鼠经MTBE 1 050 mg/(kg·bw)染毒后,不同时间大脑皮质中ATP酶活性测定结果表明:染毒后1.0 h脑皮质中Na+,K+-ATP、Ca2+-ATP酶活性与对照组比较明显降低,差异有统计学意义(P<0.05) 。染毒后8.0 h脑皮质中Na+,K+-ATP、Ca2+-ATP酶活性恢复到正常水平,与对照组比较差异无统计学意义(P>0.05) 。
2.3 MTBE对大脑皮质神经元及神经胶质细胞形态结构影响光镜下,尼氏染色正常对照组神经元呈梭形、多边形、三角形等,细胞居中,尼氏小体分布在胞浆和树突内,呈监色板块状,多而清晰。MTBE染毒剂量1 050 mg/(kg·bw)染毒后1.0 h,大脑皮质神经元无核固缩、胞体无缩小变形、胞质内尼氏小体未见消失等形态结构的改变;免疫组织化学方法观察大脑皮质神经胶质细胞胶质原纤维酸性蛋白(GFAP),特异性反映星形胶质细胞形态结构改变。结果表明,正常对照组星形胶质细胞的突起细长,分支少表面光滑,核小呈卵圆形,染色质稀少。MTBE染毒剂量1 050 mg/(kg·bw)染毒后1.0 h,大脑皮质星形胶质细胞的突起无变粗、变短,细胞核形态无变形等病理性改变。
3 讨论研究表明,MTBE对机体多系统具有急慢性毒作用[2-4]。个体接触低浓度MTBE出现头痛、眩晕、恶心等现象。大鼠吸入MTBE染毒后可出现瞳孔变小,运动失调、鸭状步、后肢握力下降等表现,严重急性中毒者出现死亡,说明MTBE具有神经毒性[5-10]。
Fos蛋白是c-fos基因的表达产物,是目前较为理想的脑功能活动的定位标记物[11]。本实验结果显示,MTBE能诱导中枢神经系统大脑皮质神经元c-fos基因表达增强,导致Fos蛋白阳性产物增多。提示MTBE可毒作用于大脑,使大脑功能发生变化,且其毒作用具有剂量-效应和时间-效应关系。
在中枢神经系统中,脑组织细胞膜上富含较高活性的Na+,K+-ATP酶、Ca2+-ATP酶[12]。本实验根据MTBE对Fos蛋白影响的2个典型时间(1.0,8.0 h)检测其对Na+,K+-ATP酶、Ca2+-ATP酶的影响。结果表明,MTBE对Na+,K+-ATP酶、Ca2+-ATP酶的作用与MTBE对Fos蛋白影响相平行。结果提示,MTBE可毒作用于大脑这一靶部位,通过降低大脑Na+,K+-ATP酶、Ca2+-ATP酶,影响神经细胞能量代谢、扰乱细胞内Na+,K+,Ca2+离子稳态从而影响神经递质的释放和兴奋性信息的传递,发挥其毒作用。
本研究表明,MTBE急性中毒时MTBE可毒作用于大脑,改变神经细胞的能量代谢,从而影响神经系统的功能,但不影响神经元和神经胶质细胞的形态结构。
| [1] | Belpoggi F, Soffritti M, Maltoni C. Methyl-tertiary-butyl ether (MTBE)-agasoline additive-causes testicular and lympho-haematopoietic cancer in rats[J]. Toxicol and Health, 1995, 11 : 119. DOI:10.1177/074823379501100202 |
| [2] | 贺性鹏, 蔡亚平, 贺栋梁, 等. 汽油添加剂甲基叔丁基醚对小鼠鼠遗传毒性作[J]. 中国职业医学, 2003, 30(1) : 8–9. |
| [3] | 张云, 骆义静, 郑刚, 等. 甲基叔丁基醚对大鼠脏器毒性作用[J]. 中国公共卫生, 2007, 23(8) : 953–955. |
| [4] | 邓学良, 贺性鹏, 唐国华, 等. 甲基叔丁基醚对小鼠外周血T淋巴细胞亚群影响[J]. 中国公共卫生, 2005, 21(8) : 936–937. |
| [5] | 邓暑芳, 李素云, 贺性鹏. 甲基叔丁基醚对胎鼠脑组织MDA、SOD及GSH的影响[J]. 南华大学学报, 2007, 35(1) : 7–9. |
| [6] | 李素云, 贺性鹏, 邓暑芳, 等. 甲基叔丁基醚对大鼠小脑r-氨基丁酸影响[J]. 中国公共卫生, 2007, 23(8) : 968–969. |
| [7] | 李素云, 邓暑芳, 邓学良, 等. 甲基叔丁基醚对大鼠小脑急性毒作用研究[J]. 南华大学学报, 2007, 35(2) : 154–157. |
| [8] | 张云, 骆文静, 郑刚, 等. 侧脑室注射甲基叔丁基醚对大鼠学习记忆的影响[J]. 中国行为医学科学, 2007, 16(1) : 10–12. |
| [9] | Martin JV, BiL gin NM, Iba MM. Influence of oxygenated fuel additives and their metabolites on the binding of a convulsant ligand of the gamma-aminobutyric aid A(GABAA)receptor in rat brain membrane preparations[J]. Toxicol Lett, 2002, 129(3) : 219–226. DOI:10.1016/S0378-4274(02)00020-6 |
| [10] | Martin JV, lyer SV, McIlroy PJ, et al. Influence of oxgennted fuel additives and their metabolties on gamma-aminobutyric aid A(GABAA)receptor function in rat brain synaptoneurosomes[J]. Toxical Lett, 2004, 147(3) : 209–217. DOI:10.1016/j.toxlet.2003.10.024 |
| [11] | 卢静, 戴体俊, 曾因明. c-fos基因表达的相关机制和意义[J]. 国外医学麻醉学与复苏分册, 2004, 25(5) : 273–275. |
| [12] | 李元涛, 戴体俊, 曾因明, 等. 安氟醚麻醉大鼠不同时期脑Ca2+-ATP酶活性变化[J]. 临床麻醉学杂志, 2005, 21(3) : 191–192. |
 2008, Vol. 24
2008, Vol. 24

 , 张建伟3, 周小兵1, 向宇燕1, 丁红梅1
, 张建伟3, 周小兵1, 向宇燕1, 丁红梅1