2. 镇江市第一人民医院检验科;
3. 江苏大学医学技术学院微生物教研室;
4. 南通市肿瘤医院检验科
幽门螺杆菌(Helicobacter pylori,Hp)是上消化道疾病的主要致病菌,人群感染率在50%以上。感染呈全球性分布,其分泌的空泡毒素(VacA)在Hp致病过程中起重要作用。研究显示,硒作为一种人体必需微量元素,具有广泛的生物学活性[1],在预防克山病和某些癌症以及延续衰老中发挥着重要作用。本文研究硒对Hp VacA及重组VacA的影响,进一步探讨硒的作用,为硒产品的开发及Hp感染的诊治提供实验方法及理论依据。
1 材料与方法 1.1 材料(1)细胞株与菌株:SGC-7901细胞株(吉林省肿瘤研究所);pET32a-vacA-E.coli BL21(DE3) 工程菌株(浙江大学微生物教研室严杰教授惠赠);Hp(NCTC11637)标准菌株(中国预防医学科学院流病研究所)。(2)主要试剂:Ni-TEDTM(美国Activemotif公司);哥伦比亚琼脂及气体发生袋(中国预防医学科学院流病研究所);RPMI1640培养粉(美国Life Technologies公司);亚硒酸钠(Na2SeO3·5H2O;沈阳市试剂五厂)。
1.2 方法 1.2.1 Hp培养、VacA提取及纯化(1) Hp培养:将Hp标准菌株等量接种于含15%胎牛血清牛脑心浸液中(含硒量分别为0,1,6,12,18,24 mmol/L),37℃微需氧振摇培养3 d后,721型分光光度计测各管菌液吸光度(A)值,革兰染色观察菌体形状,透射电镜观察Hp结构改变。(2) VacA提取及纯化:将培养液12 000 r/min离心15 min,上清即为粗提VacA。用半饱和硫酸铵(25℃硫酸铵50%饱和度为313 g/L)于4℃沉淀2次,沉淀物以磷酸盐缓冲液(PBS)4℃透析过夜。将此提纯的VacA过Sephade× G200柱(30 cm×1.0 cm),收集具有VacA活性的色谱峰,聚乙二醇(PEG)浓缩,0.22 μm滤膜抽滤,-20℃保存备用。
1.2.2 pET32a-vacA-E.coliBL21(DE3) 工程菌株培养及重组VacA表达、提取、纯化及抗原性鉴定按参考文献[2, 3]。
1.2.3 加硒培养pET32a-vacA-E.coli BL21(DE3) 工程菌株取装有10 ml质脂双层(LB,含氨苄青霉素100 mg/L)液体培养基的大试管,接种单个质粒阳性的大肠埃希菌落,150 r/min,37℃振摇培养过夜。取6支大试管,每支内加入灭菌LB培养液9 ml(含氨苄青霉素100 mg/L),各加入上述培养过夜的菌液1 ml,再加入硒液,使各管硒的终浓度分别为0,1,6,12,18,24 mmol/L;150 r/min,37℃振摇培养,连续测菌液吸光度(A)值,观察硒对大肠埃希菌生长的影响。
1.2.4 硒对2种VacA作用的影响(1)SGC-7901细胞复苏、培养、传代和冻存按参考文献[4]方法。(2)硒对2种VacA细胞毒性作用影响:取对数期的SGC-7901细胞5×104个/ml培养24 h,将纯化的二种VacA经0.22 μm滤膜抽滤后,各取0,50,100,200 μl平行加至细胞培养瓶中,另2组同样处理的培养细胞内分别加入亚硒酸钠溶液,使其终浓度分别为0,1,6,12,18,24 μmol/L,再取一组至对数生长期细胞,细胞内只加入同等上述量的硒溶液,留一组细胞做空白对照;37℃ CO2培养箱内与细胞共同培养12,24,48,72 h,倒置显微镜下连续观察细胞生长状态并照像。培养3 d后的所有细胞,分别用胰酶消化制成单个细胞,2 000 r/min离心10 min,制成紧密的细胞团;2.5%戊二醛前固定,1%锇酸后固定,乙醇系列脱水,Epon 812环氧树脂包埋;LKB-III型超薄切片机定位后做超薄切片;醋酸双氧铀及柠檬酸铅双重染色,JEM-120EX型透射电子显微镜观察、摄片。同时将连续培养3 d的细胞依次制成5×106/ml细胞悬液,用PBS洗2次,加入5 ml 70%乙醇混匀;4℃固定24h后,测试前1 000 r/min离心5min,去除乙醇;PBS洗2次,用PBS制成1ml细胞悬液,加入RNA酶,使其终浓度为50 mg/L;37℃水浴消化1 h,再加入碘化丙啶(PI)使其终浓度为50 mg/L;避光4℃染色30 min,200目网筛滤过,进行流式细胞仪检测分析。
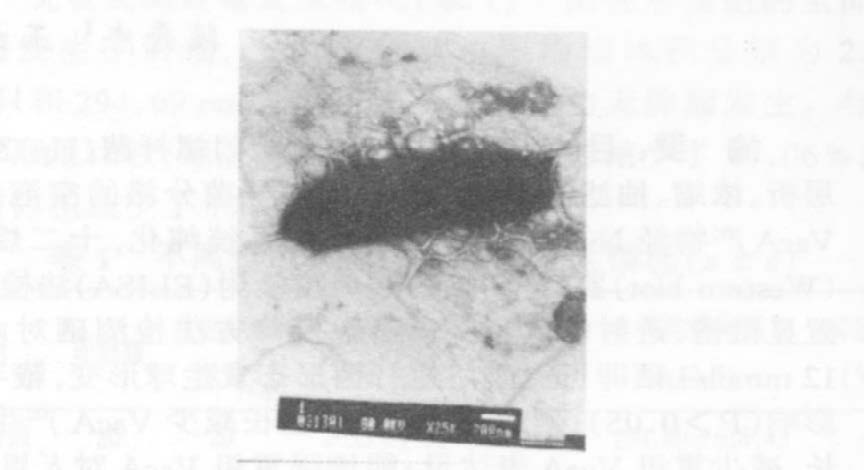
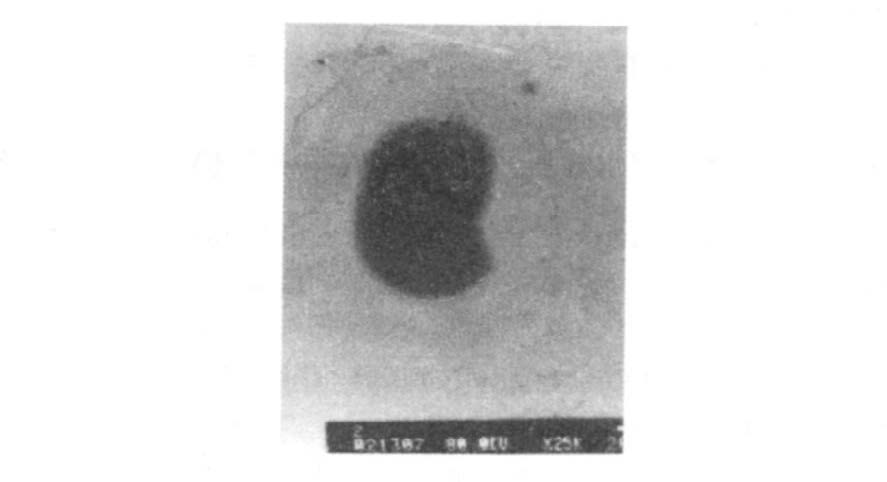
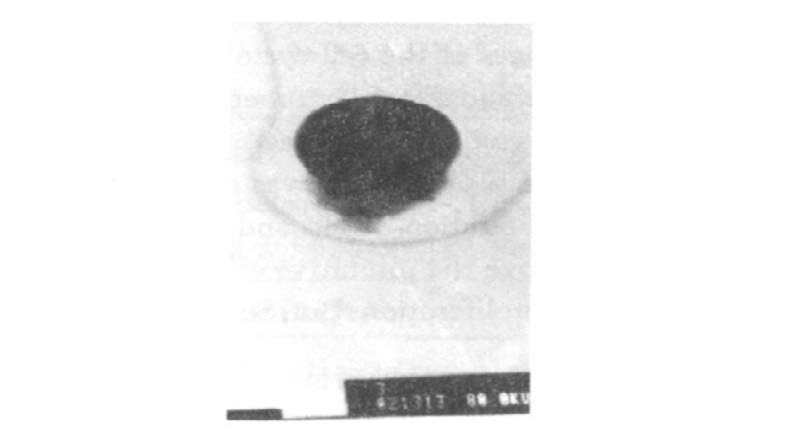
2 结果 2.1 硒对Hp生长及形态结构影响培养3 d后,Hp菌液浊度经721型分光光度计检测显示,随着硒浓度的增加而浊度减低,革兰染色观察发现,从硒含量在0~6 mmol/L管内细菌呈典型弧形,12 mmol/L管内细菌有个别呈圆球形,18及24 mmol/L管内的细菌则多数呈现出球形变,革兰染色不典型。透射电镜显示,球形变细菌鞭毛消失,但菌膜完整。VacA提取量亦随着硒含量的增加而减少(图 1~3) 。
|
图 1 无硒培养Hp |
|
图 2 12 mmol/ L 硒培养Hp |
|
图 3 18 mmol/ L 硒培养Hp |
2.2 硒对pET32a-vacA-E.coli
BL21(DE3) 工程菌株生长影响(表 1)
| 表 1 硒对pET32a-vacA-E.coli工程菌生长影响[吸光度(A) 值] |
加硒培养工程菌,产砖红色色素。经LB固体培养结果表明,该色素为脂溶性,局限于菌落而不向四周扩散,并随着硒浓度增加颜色逐渐加深。721型分光光度计检测显示,工程菌生长随硒浓度增加受抑制。表 1可见,细菌培养4 h后,低浓度的硒(1,6 mmol/L)可促进E.coli工程菌生长(P<0.05);随着硒浓度的增加,工程菌生长抑制明显,6 mmol/L浓度的加硒组与无硒组比较,细菌A值差异无统计学意义(P>0.05) 。12,18,24 mmol/L加硒组细菌生长A值与无硒组比较,差异有统计学意义(均P<0.01)。
2.3 硒对Hp提取VacA及重组VacA细胞毒性作用影响 2.3.1 Hp提取VacA细胞毒作用Hp提取VacA作用于SGC-7901细胞,6 h后即出现比较小的空泡,随着培养时间延长,越来越多的SGC-7901细胞呈现空泡样变,而且空泡数目逐渐增多,体积逐渐增大;1 d后呈强毒性作用,但SGC-7901细胞多数仍能贴壁生长,2 d后部分细胞开始逐渐体积膨胀死亡,漂浮于培养液中,经3 d培养后,多数细胞死亡;而未加空泡毒素的阴性对照培养细胞生长状态良好,连续培养4 d细胞形态未见明显改变。
2.3.2 硒对Hp提取VacA细胞毒作用的影响将加硒培养Hp提取VacA细胞毒致空泡样变分为:低于40%细胞空泡样变定为阴性(-),40%以上为阳性(+),其中75%为++,90%为+++,100%为++++。结果发现,随着硒浓度的增加,细胞空泡变作用减弱。为了解这种减弱是因硒抑制Hp生长而使VacA产量减少,还是由于硒可直接抑制VacA空泡毒作用,采取无硒培养Hp提取空泡毒素,再与硒作用。结果显示,细胞空泡样变的规律与前述结果基本相同,组间比较差异无统计学意义(P>0.05),表明硒对VacA空泡毒作用无影响。
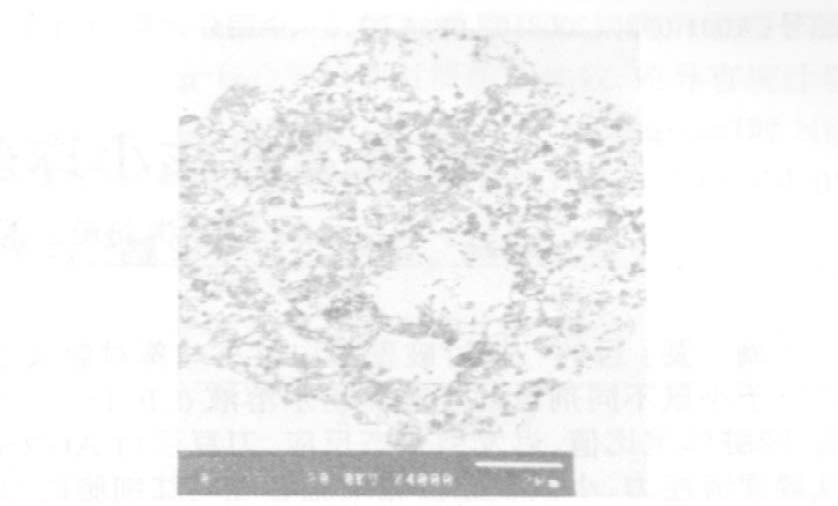
2.3.3 硒对重组VacA细胞毒作用的影响与无硒组比较,硒能促进重组VacA对SGC-7901细胞的凋亡作用及其生长抑制作用。倒置显微镜观察显示,细胞生长进一步受到抑制,细胞空化更为明显,核固缩、胞质内基质及细胞器均呈空化状改变(图 4,5)。

|
图 4 正常SGC- 7901 细胞 |
|
图 5 24μmol/ L 硒及200μl 重组VacA 作用SGC- 7901 细胞 |
3 讨论
Hp感染是许多慢性胃病发生、发展中的一个重要致病因子,WHO已将其列为I类致癌原。Hp感染后,有的会发展为胃癌,而有的却发展为消化性溃疡。LeonBR,等[5]认为这2种结局与地域相关的一些营养素作用有关,会影响Hp感染性早期慢性活动性胃炎向萎缩性胃炎的转化。这些因素包括有抗氧化作用的微量元素硒以及维生素C等[6]。Yücelüstündag等[1]研究发现,胃窦炎患者其胃窦组织硒水平与Hp感染有关,而与血浆硒水平无关。胃窦组织中硒水平升高是为了抵抗由于Hp 感染而增加的活性氧。邵世和等[7]研究表明,一定浓度的亚硒酸钠可增强小鼠胃粘膜CD4细胞活性,使CD4/CD8比例上调,从而提高机体的细胞免疫和体液免疫,对Hp 引起的胃黏膜损害起到保护作用。本文研究表明,硒通过抑制幽门螺杆菌生长从而抑制了空泡毒素的产量,其抑制的机制尚待进一步研究。硒不能改变VacA的空泡活性。硒通过抑制pET32a-vacA-E.coli BL21(DE3) 工程菌生长从而减少重组VacA的表达产量,硒能促进重组VacA诱导SGC-7901细胞的凋亡作用及其生长抑制作用。其具体作用机制尚待研究。
| [1] | Yücel üstündag, Sedat Boyacioglu MD, Menzel J, et al. Plasma and gastric tissue selenium levels in patients with Helicobacter pylori infection[J]. J Clin Gastroenterol, 2001, 35(5) : 405–408. |
| [2] | 段秀杰, 邵世和, 闻平, 等. 幽门螺杆菌VacA重组蛋白对SGC7901胃癌细胞的作用[J]. 世界华人消化杂志, 2006, 14(1) : 92–95. |
| [3] | 段秀杰, 邵世和, 闻平, 等. 幽门螺杆菌VacA重组蛋白表达、纯化及鉴定[J]. 中国微生态学杂志, 2006, 18(1) : 27–28. |
| [4] | 司徒镇强. 细胞培养[M].4版. 北京: 世界图书出版公司, 2001: 186-187. |
| [5] | Leon BR, berendson SR, Recararren AS. Geographic facrors probably modulating alternative pathways in helicobacter pylori-associated gastroduodenal pathology a hypothesis[J]. Clin Infect Dis, 1997, 25(5) : 1013–1016. DOI:10.1086/cid.1997.25.issue-5 |
| [6] | Seyler Rw Jr, Olson JW. Superoxide dismutase-deficient mutants of Helicobacter Pylori are hypersensitive to oxidative stress and defective in host colonization[J]. Infect Immun, 2001, 69 : 4034–4040. DOI:10.1128/IAI.69.6.4034-4040.2001 |
| [7] | 邵世和, 刘继斌, 段秀杰, 等. 亚硒酸钠对幽门螺杆菌所致小鼠胃黏膜组织损伤的免疫保护作用[J]. 营养学报, 2005, 127(5) : 394–396. |
 2008, Vol. 24
2008, Vol. 24

 , 刘继斌4
, 刘继斌4 