2. 天津医科大学公共卫生学院;
3. 中国人民解放军总医院营养科
近年研究表明,低密度脂蛋白(LDL)可氧化修饰成为氧化低密度脂蛋白(ox-LDL),而ox-LDL所致血管内皮细胞损伤是动脉粥样硬化(AS)形成的重要因素之一[1, 2]。许多天然食物具有抗氧化作用,大豆在预防(AS)方面具有重要作用。研究表明,大豆中的大豆异黄酮(SI)具有多种生物活性,而其抗AS作用成为近年来研究的热点[3]。目前,对SI的研究多注重于动物实验和临床观察,人体细胞水平的研究较少。本实验采用体外培养人脐静脉血管内皮细胞(HUVECs)的方法,研究SI对氧化损伤HUVEC凋亡作用的影响,从细胞水平探讨SI对血管内皮细胞的保护作用。
1 材料与方法 1.1 材料与仪器人脐静脉血管内皮细胞为ECV-304细胞株(天津市环湖医院);LDL(中国医学科学院基础医学研究所);SI、维生素E(VE)、胰蛋白酶均(美国Sigma公司);胎牛血清细胞培养液(DMEM)(美国Gibco公司);新生胎牛血清(美国Hyclone公司)。细胞培养板(美国Costar公司)。其他试剂均为国外或国产分析纯试剂。乳酸脱氢酶(lactate dehydrogenase,LDH)测试盒、细胞凋亡检测试剂盒(南京建成生物工程研究所)。主要仪器:酶标仪(奥地利TECAN公司);二氧化碳水套培养箱(美国热电公司);倒置荧光显微镜(日本Olympus公司)。
1.2 ox-LDL制备将LDL在浓度为10 μmol/L的乙二胺四乙酸(EDTA)透析液中4℃避光透析24 h后,加入CuSO4,使Cu2+终浓度为10 μmol/L,4℃避光氧化24 h,用终浓度为100 μmol/L的EDTA终止氧化,静置2 h,为ox-LDL。LDL氧化后由浅黄变为乳白,采用测定其丙二醛(MDA)含量确定氧化程度。
1.3 血管内皮细胞的培养与鉴定冻存血管内皮细胞复苏后,用含10%胎牛血清的DMEM细胞培养液接种于细胞培养板中,于37℃、5%CO2、95%空气饱和湿度培养箱中培养;细胞生长融合成致密单层,倾去培养液,用0.25%胰蛋白酶与0.2%乙二胺四乙酸钠(EDTA-Na2) 等量混合消化,以1:2传代培养。实验采用生长融合成单层的细胞。血管内皮细胞鉴定采用Ⅷ因子相关抗原免疫组化染色法。
1.4 方法(1) VE和SI的溶解:VE、SI均用无水乙醇和二甲基亚砜(DMSO)混合溶解。(2) 剂量分组:实验分空白对照组、氧化损伤对照组(ox-LDL的MDA含量为1nmol/m1) 、氧化损伤加入VE对照组(VE+ox-LDL,50 μmolVE/L)、氧化损伤加入大豆异黄酮低、中、高浓度组(SI-L+ox-LDL、SI-M+ox-LDL、SI-H+ox-LDL;SI浓度分别为10,50,100 mol/L)。(3) 实验方法:取传代培养生长融合成单层的细胞,倾去培养液,用磷酸盐缓冲液(PBS)洗2~3遍,换新细胞培养液,按实验剂量分组要求加入VE、SI预孵24 h,再与除菌后的ox-LDL继续培养24 h,终止培养,收集细胞,测定抗氧化指标。
1.5 指标测定 1.5.1 四甲基偶氮噻唑蓝(MTT)比色法测定细胞活力细胞终止培养后,加入MTT,于37℃、5%CO2、95%空气饱和湿度培养箱中培养4h,小心吸出细胞培养液,加入DMSO,用酶标仪于490nm处测定吸光度(A)值。
1.5.2 LDH释放测定采用常规酶法,操作步骤按LDH测试盒说明进行。取样量为10μl,各试剂量均减半,用半自动生化仪于440 nm处测定细胞培养液(细胞外:out)和上清液(细胞内:in)A值,并计算LDH释放百分比(%)。计算公式为[4]:
终止培养的细胞,倾去培养液,用PBS洗2遍,95%乙醇固定30 min,自然风干,再用PBS洗3 min×2次,进行细胞凋亡标记染色;采用脱氧核糖核苷酸未端转移酶(TDT)介导的原位末端标记法(TUNEL),按试剂盒说明进行。选择TDT酶标记,原位细胞凋亡检测剂盒(POD)作信号转化,二氨基联苯胺(DAB)为底物;凋亡指数(AI)计算:计数视野内1 000个细胞中的凋亡细胞数。计算公式为[5]:
采用SPSS 10.0统计软件进行分析,各组间比较采用单因素方差分析。
2 结果 2.1 SI对氧化损伤血管内皮细胞活力和LDH的影响(表 1)| 表 1 SI对氧化损伤血管内皮细胞活力和LDH的影响(x ± s, n = 6) |
2.2 SI对氧化损伤血管内皮细胞凋亡的影响(表 2)
| 表 2 SI对氧化损伤血管内皮细胞AI(‰)的影响(x ± s, n = 6) |
2.3 光学下观察SI对血管内皮细胞凋亡的影响(图 1,2)
镜下可见,凋亡细胞胞核被染成棕色或棕褐色,正常细胞胞核被染成蓝色。ox-LDL组细胞胞核被染成棕色或棕褐色的凋亡细胞远远多于空白对照组,SI-L+ox-LDL组凋亡细胞数有所减少,而SI-M,H+ox-LDL组及VE+ox-LDL组凋亡细胞与空白对照组相似。
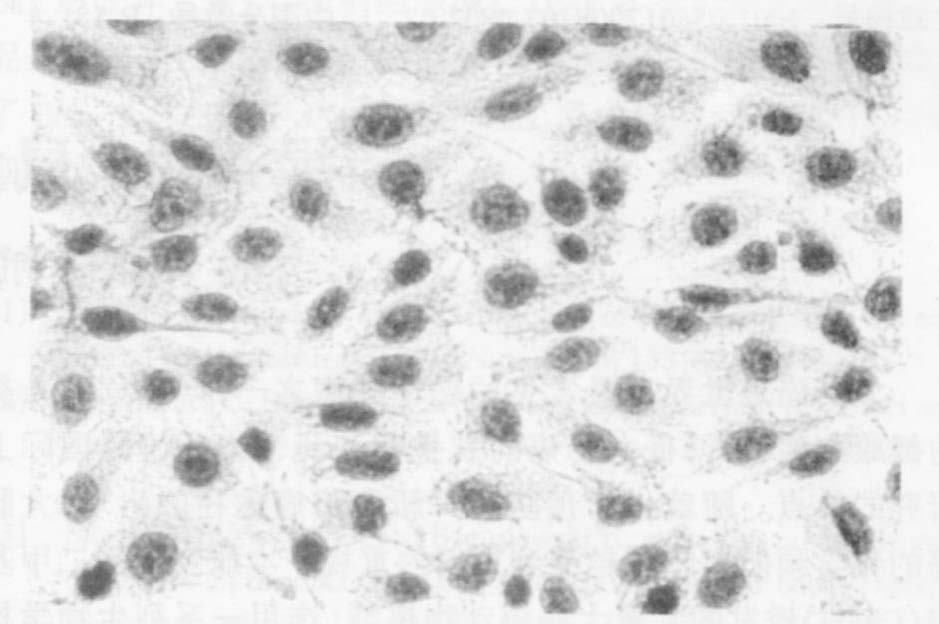
|
图 1 ox - LDL 组凋亡细胞形态(×200) |
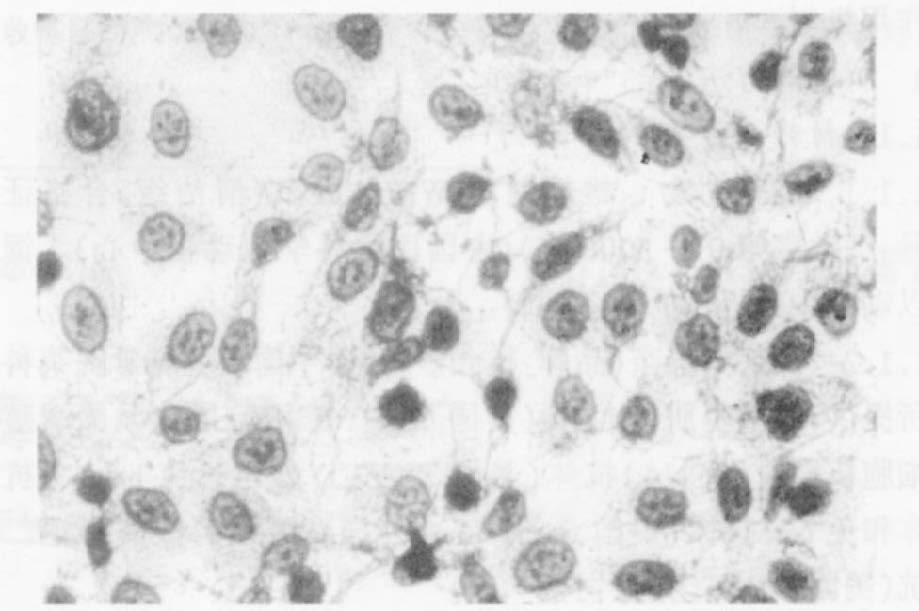
|
图 2 SI - M+ ox - LDL 组(SI 为50μmol/ L) 凋亡细胞形态(×200) |
3 讨论
ox-LDL可损伤血管内皮细胞可导致细胞凋亡,诱导AS的形成[6, 7]。本研究显示,ox-LDL可损伤血管内皮细胞,ox-LDL组AI明显高于空白对照组,差异有统计学意义(P<0.01) 。光学显微镜下观察,胞核被染成棕色或棕褐色的凋亡细胞也远远多于空白对照组,说明ox-LDL诱导细胞凋亡。而SI各剂量组血管内皮细胞与空白对照组比较,AI明显降低,差异有统计学意义(P<0.01) ,光学显微镜下观察凋亡细胞数也有所减少,说明SI可抑制ox-LDL诱导的血管内皮细胞凋亡。SI预防AS作用的机制之一可能为抑制ox-LDL诱导的血管内皮细胞凋亡。SI与VE对氧化损伤血管内皮细胞均具有保护作用,且同浓度的SI与VE作用相似。综上所述,SI抑制氧化损伤血管内皮细胞调亡可能是预防动脉粥样硬化的作用机制之一。
| [1] | 卢次勇, 凌文华, 马静, 等. 氧化型低密度脂蛋白诱导内皮细胞基因表达[J]. 中国公共卫生, 2004, 20(7) : 786–787. |
| [2] | Stocker R, Keaney F JF. Role of oxidative modifications in atherosclerosis[J]. Physiol Rev, 2004, 84(4) : 1381–1478. DOI:10.1152/physrev.00047.2003 |
| [3] | 刘亚琴, 黄兆铨. 大豆异黄酮抗动脉粥样硬化作用的研究进展[J]. 心脑血管病防治, 2007, 7(2) : 120–122. |
| [4] | 徐东芳, 朱长太, 刘东梅, 等. 三种培养液进行海马神经元原代培养的对比研究[J]. 安徽医科大学学报, 2006, 41(5) : 521–524. |
| [5] | 马吉祥, 苏军英, 李会庆, 等. 大豆异黄酮诱导胃癌细胞凋亡作用研究[J]. 中国公共卫生, 2003, 19(4) : 434–436. |
| [6] | Norata GD, Tonti L, Roma P, et al. Apoptosis and proliferation of endothelial cells in early atherosclerotic lesions:possible role of oxidised LDL[J]. Nutr Metab Cardiovasc Dis, 2002, 12(5) : 297–305. |
| [7] | 张翠丽, 林琳, 邹昕. 内皮细胞凋亡与动脉粥样硬化[J]. 心血管病学进展, 2007, 28(2) : 235–237. |
 2008, Vol. 24
2008, Vol. 24

 , 刘英华3, 常红2, 刘莉2, 任大林2
, 刘英华3, 常红2, 刘莉2, 任大林2 
