2. 清华大学生物科学与技术系;
3. 河南中医学院
植物单宁在许多植物食品和中药材含量丰富。研究显示,美国人每天摄入单宁化合物单宁酸1g左右[1]。没食子酸是可水解单宁完全水解的终产物,没食子酸及其衍生物还作为抗氧化剂而在许多国家批准为食品添加剂。研究发现,没食子酸可引起实验动物严重的全血血红蛋白(Hb)降低、红细胞压积和红细胞数量下降等贫血表现[2-5]。K562细胞系是研究红系和巨核细胞系分化的重要模型,氯化高铁血红素(hemin)、蒽环类化合物(anthracyclines)和丁酸钠(BA)等可诱导其向红系分化,而佛波酯可诱导其向巨核细胞分化[6, 7]。本实验研究可水解单宁诃子酸(CA)和特里马素I(T)对氯化高铁血红素和丁酸钠诱导K562细胞红系分化的影响。
1 材料与方法 1.1 材料诃子酸和特里马素I(纯度>95%,河南中医学院刘延泽教授提供);RPMI 1640培养基(美国Invitrogen公司);胎牛血清(FBS,美国HyClone公司);青霉素、链霉素、氯化高铁血红素、丁酸钠、3-(4,5-二甲基噻唑-2) -2,5-二苯基四氮唑溴盐、四甲基偶氮噻唑蓝(MTT)(美国Sigma公司)。藻红素(PE)标记抗血型糖蛋白A(GPA)单克隆抗体、PE标记小鼠同种型(isotype)IgG1(美国Caltag公司)。主要仪器:流式细胞仪(美国Beckman公司);全自动酶标仪(美国Bio-Rad公司)。
1.2 细胞培养K562细胞培养在含有10%FBS、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养基中于5%CO2培养箱中37℃培养。实验时,取指数生长期细胞重新悬浮于新鲜培养基中,培养24 h后开始实验,诱导细胞分化时加入0.04 mmol/L氯化高铁血红素或0.5 mmol/L丁酸钠。
1.3 MTT检测细胞毒性将指数生长期K562细胞,用培养液制成5×104细胞/ml细胞悬液,以每孔200 μl(1×104细胞)接种于96孔培养板中,37℃培养,24 h后加入不同浓度的诃子酸或特里马素I,即0 ,0.04,0.05,0.06,0.07,0.08,0.09 mmol/L,继续培养24 h,换以新鲜培养液,每孔加入5 mg/ml MTT 20 μl,于37℃再培养4 h,离心弃除培养液,加入200 μl二甲基亚砜,充分振荡溶解后用酶标仪测定550 nm波长处各孔的吸光度(A)值(A550) 。
1.4 联苯胺染色法检测血红蛋白合成应用联苯胺/H2O2可使含Hb细胞着色为蓝色检测细胞Hb合成情况[8]。将指数生长期K562细胞,以1×105细胞/ml密度接种于24孔培养板中,37℃、5%CO2培养,24h后加入0.04 mmol/L氯化高铁血红素或0.5 mmol/L丁酸钠,同时加入不同浓度的诃子酸或特里马素I,对于氯化高铁血红素处理细胞,诃子酸或特里马素I加入0,0.01,0.02 ,0.03,0.04,0.05 mmol/L;对于丁酸钠处理细胞,诃子酸或特里马素I加入0,0.002,0.004,0.006,0.008,0.01 mmol/L。然后于作用后0.24,48,72,96,120,144,168 h等时间点收集细胞用PBS洗3次,制备成细胞悬液,加入1/10体积的联苯胺/H2O2显色液(含0.2%联苯胺、0.5 mol/L冰乙酸,临用时加入0.4%的30%H2O2) ,显色10 min,染色后细胞用血细胞计数板在光镜下计数500个细胞中Hb阳性细胞数,计算Hb阳性细胞比例。
1.5 流式细胞术检测细胞表面抗原GPA表达情况应用PE标记抗GPA抗体利用流式细胞仪分析K562细胞表面抗原GPA的表达情况。PE-IgG1作为相应抗体的阴性对照抗体。将指数生长期K562细胞,以1×105细胞/ml密度接种于24孔培养板中,37℃、5%CO2培养,24 h后加入0.5 mmol/L BA,同时加入0.01 mmol/L的诃子酸或特里马素I。然后于作用72 h后收集细胞进行免疫荧光标记。步骤如下:1 000 r/min离心5 min,收获细胞;PBS-B悬浮细胞,1000 r/min离心5 min;PBS-B 200 μl悬浮沉淀,计数;每管留1.0×106细胞;加入荧光染料标记抗体,避光4℃孵育30 min;1 000 r/min离心5 min,PBS-B悬浮沉淀;流式细胞仪检测。
1.6 统计分析应用Student's t检验进行分析。
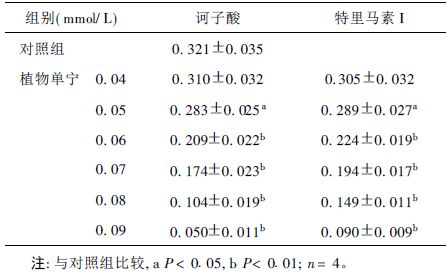
2 结 果 2.1 诃子酸和特里马素I对K562细胞的生长的毒性作用(表 1)| 表 1 植物单宁对K562细胞生长(A550mm)影响(x ± s) |
K562细胞经不同浓度的诃子酸和特里马素I作用24 h,然后用MTT法检测细胞生长情况。0.04 mmol/L诃子酸和特里马素I处理的K562细胞的细胞生长相对于对照组细胞有轻度降低,而当单宁浓度达0.05 mmol/L及以上时,细胞的数量显著降低,并随着浓度增加细胞数量减少程度越高。
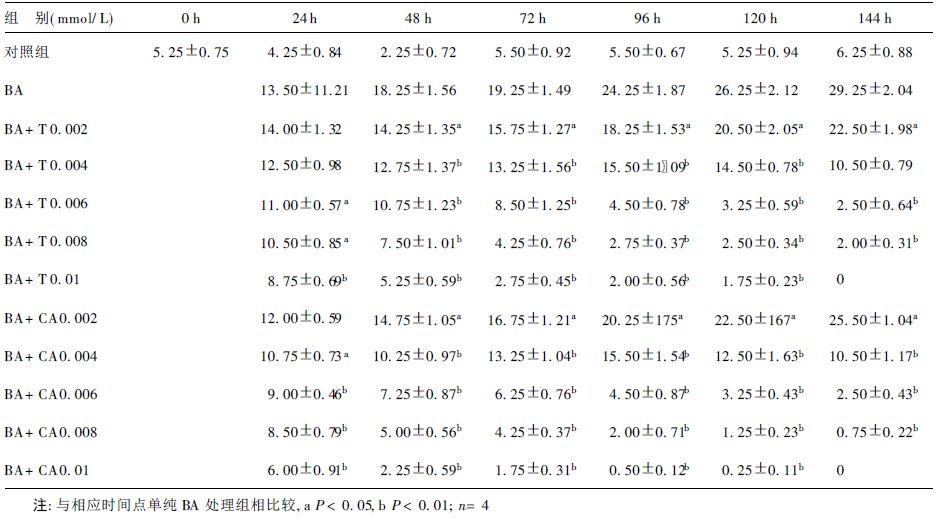
2.2 诃子酸和特里马素I抑制氯化高铁血红素和BA诱导K562细胞Hb合成(表 2,3)| 表 2 特里马素I和诃子酸作用下对丁酸钠诱导K562细胞血红蛋白合成的影响(%,x ± s) |
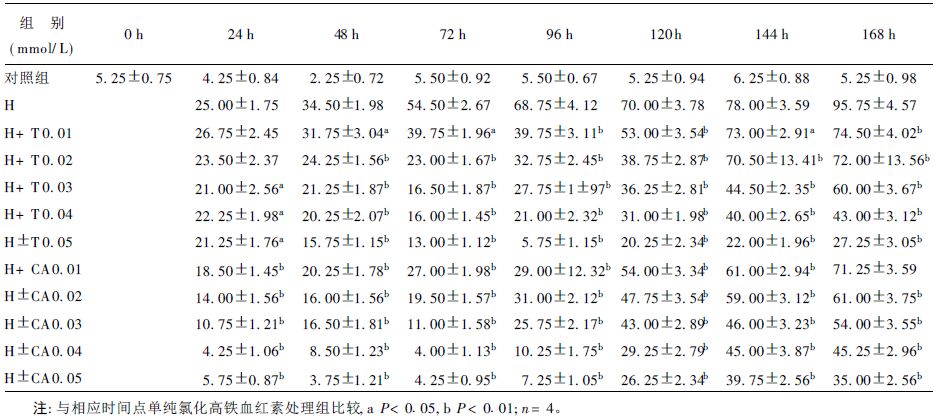
| 表 3 特里马素I和诃子酸对氯化高铁血红素诱导K562细胞血红蛋白合成的影响(%,x ± s) |
应用联苯胺染色法检测K562细胞Hb合成情况。经0.04 mmol/L氯化高铁血红素或0.5 mmol/L丁酸钠(BA)作用不同时间后K562细胞有一部分细胞为联苯胺染为蓝色,表明细胞有Hb合成,其中BA处理细胞的Hb阳性率在144 h时达到高峰(29.25±2.04) %,氯化高铁血红素处理细胞的Hb阳性率在168 h时达到高峰(95.75±4.57) %。在K562细胞经过0.5 mmol/L BA和不同浓度的诃子酸或特里马素I作用不同时间后,Hb阳性细胞比例相对于单纯诱导剂处理细胞而言明显降低,并表现出浓度依赖性,表明该2种可水解单宁均可抑制BA诱导K562细胞Hb合成。同样,诃子酸和特里马素I还可抑制0.04 mmol/L氯化高铁血红素诱导K562细胞Hb合成,并有浓度依赖性。
单宁对BA诱导的Hb合成的抑制作用要强于对氯化高铁血红素诱导的Hb合成的抑制作用。在BA诱导的K562细胞,2种单宁化合物在0.002 mmol/L时就对Hb合成有抑制作用,当浓度达到0.01 mmol/L时,Hb阳性细胞就降到对照水平(5%左右)。然而,在氯化高铁血红素诱导的K562细胞,0.01 mmol/L的诃子酸和特里马素I对Hb的合成只有轻度抑制作用,浓度为0.05 mmol/L时,Hb阳性细胞水平降低但仍在对照水平以上。
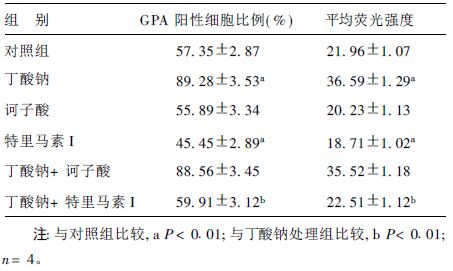
2.4 特里马素I对K562细胞表面血型糖蛋白A表达的抑制作用(表 4)| 表 4 诃子酸和特里马素I处理K562细胞后其GPA表达(x ± s) |
GPA也是红细胞分化的分子标志之一。因此,应用免疫荧光和流式细胞术检测诃子酸和特里马素I对K562细胞GPA表达的影响。尽管对照K562细胞有较高GPA蛋白表达。K562细胞经0.5 mmol/L BA作用72 h后GPA表达显著升高;0.01 mmol/L诃子酸和0.01 mmol/L特里马素I分别作用K562细胞72 h后,诃子酸作用的细胞GPA表达没有明显变化,而特里马素I处理细胞GPA表达明显下降;相对于BA处理细胞而言,当BA和特里马素I同时作用时,细胞GPA表达水平明显降低,又回到对照细胞水平,表明特里马素I的存在抑制了BA诱导的GPA表达上调;而诃子酸和BA共同处理的细胞和单独BA处理细胞之间的GPA表达水平差别没有统计学意义。另外,氯化高铁血红素对K562细胞的GPA表达没有明显影响。
3 讨 论可水解单宁化合物诃子酸和特里马素I均可抑制氯化高铁血红素和BA诱导的K562细胞Hb合成,特里马素I还抑制BA对GPA蛋白表达的诱导作用,表明诃子酸和特里马素I可抑制K562细胞向红系诱导分化。研究显示,短链脂肪酸如BA和丙酸盐为结直肠癌细胞的有效抑制剂,可引起此类细胞的氧化应激[9]。研究还显示,BA引起的氧化应激也参与BA诱导的K562细胞红系分化过程[10]。尽管有文献报道,氯化高铁血红素是非氧应激相关的、可逆的红系分化诱导剂,有研究显示,氯化高铁血红素可诱导肝脏和血循环等组织器官的氧化应激[11, 12]。而且,氯化高铁血红素处理的K562细胞向红系分化的同时,会调节氧化应激相关蛋白的表达[14];抗氧化剂N-乙酰半胱氨酸在高浓度对氯化高铁血红素诱导分化也有一定抑制作用[10],表明氯化高铁血红素诱导分化与氧化应激也有一定关系。而诃子酸和特里马素I均具有很强的抗氧化能力[14, 15]。提示,诃子酸和特里马素I对BA和氯化高铁血红素诱导的红系分化的抑制作用可能与其强的抗氧化作用有关,但具体机制还有待进一步研究。
| [1] | Sanyal R, Darroudi F, Parzefall W, et al. Inhibition of the genotoxic effects of heterocylic amines in human derived hepatoma cells by dietary bioantimutagens[J]. Mutagenesis, 1997, 12 : 297–303. DOI:10.1093/mutage/12.4.297 |
| [2] | Orten JM, Kuyper AC, Smith AH. Studies on the toxicity of propyl gallate acid of antioxidant mixtures containing propyl gallate[M].1948: 308. |
| [3] | Heijden CAVD, Janssen PJ, Strik JJ. Toxicology of gallates:a review and evaluation[J]. Food Chem Toxicol, 1986, 24 : 1067–1070. DOI:10.1016/0278-6915(86)90290-5 |
| [4] | Niho N, Shibutani M, Tamura T, et al. Subchronic toxicity study of gallic acid by oral administration in F344 rats[J]. Food Chem Toxicol, 2001, 39 : 1063–070. DOI:10.1016/S0278-6915(01)00054-0 |
| [5] | Rajalakshmi K, Devaraj H, Niranjali DS. Assessment of the no-observed-adverse effect level(NOAEL)of gallic acid in mice[J]. Food Chem Toxicol, 2001, 39 : 919–922. DOI:10.1016/S0278-6915(01)00022-9 |
| [6] | Alitalo R. Induced differentiation of K562 leukemia cells:a model for studies of gene expression in early megakaryoblasts[J]. Leuk Res, 1990, 14 : 501–514. DOI:10.1016/0145-2126(90)90002-Q |
| [7] | Sutherjand JA, Turner AR, Manllolli P, et al. Differenciation of K562 leukemia cells aloilg erythroid,macrophage and megalaryocyte lineages[J]. J BiolResp Mod, 1986, 5 : 250–262. |
| [8] | Ngo Nyoung M, Trentesaux C, Aries A, et al. Effect of aclacinomycin doxorubicin association on differentiation and growth of human erythroleukemic K562 cells[J]. Anticancer Res, 1994, 14 : 1203–1208. |
| [9] | Giardina C, Inan MS. Nonsteroidal anti-inflatomatory drugs,short-chain fatty acids,and reactive oxygen metabolism in human colorectal cancer cells[J]. Biochim Biophys Acta, 1998, 1401 : 277–288. DOI:10.1016/S0167-4889(97)00140-7 |
| [10] | Chenais B, Andriollo M, Guiraild P, et al. Oxidative stress involvement in chemically induced differenciation of K562 cells[J]. Free Radic Biol Med, 2000, 28 : 18–27. DOI:10.1016/S0891-5849(99)00195-1 |
| [11] | Eratio MA, Gonzales S, Noriega GO, et al. Bilirubin and ferritin as protectors against hemin-induced oxidative stress in rat liver[J]. Cell Mol Biol, 2002, 48 : 877–884. |
| [12] | Phumala N, Porastlphataria S, Uncherrl S, et al. Hemin:a possible cause of oxidative stress in blood circulation of beta-thalassemia/hemoglobin E disease[J]. Free Radic Res, 2003, 37 : 129–135. DOI:10.1080/1071576031000060607 |
| [13] | Iwasaki K, Mackenzie EL, Hailemariam K, et al. Hemin-mediated regulation of an antioxidant-responsive element of the human ferritin H gene and role of Ref-1 during erythroid differentiation of K562 cells[J]. Mol Cell Biol, 2006, 26 : 2845–2856. DOI:10.1128/MCB.26.7.2845-2856.2006 |
| [14] | Kimllra Y, Okuda T, Okuda T, et al. Studies on the activities of tannins and related compounds V:Inhibitory effects on lipid peroxidation in mitochondria and microsome of liver[J]. Planta Med, 1984, 50 : 473–477. DOI:10.1055/s-2007-969776 |
| [15] | Okamura H, Mimura A, Yakou Y, et al. Antioxidant activity of tannins and flavonoids in Eucalyptus rostrata[J]. Phytochem, 1993, 33 : 557–561. DOI:10.1016/0031-9422(93)85448-Z |
 2008, Vol. 24
2008, Vol. 24