2. 湖北省武汉市水务集团有限公司水质监测中心;
3. 湖北省武汉市东西湖自来水公司
我国城市大部分水厂饮用水处理以常规处理工艺为主,主要包括源水预氯、混凝沉淀、沉淀、过滤、加氯消毒,在此过程中有2次加氯,由此产生的氯化消毒副产物对健康具有潜在危害[1]。3-氯4-二氯甲基-5-羟基-2(5氢)-呋喃酮(MX)是由水中的有机化合物(尤其是腐殖质)与氯反应形成的具有极强诱变作用的饮水氯化消毒副产物[2],其致突变性占氯化消毒自来水总致突变性的15%~67%[3, 4]。体内、外试验表明,MX可引起哺乳动物细胞多种遗传损害,表现为基因突变、DNA损伤、染色体畸变、姊妹染色单体交换等[5, 6]。动物试验表明,MX可诱导大鼠的多器官肿瘤[7],并可在多种肿瘤的发生过程中起到促癌作用[8]。2001年Chen等报道,MX生成量随总有机碳(TOC)浓度的增大而显著增加[9]。2002年Wright等发现,饮用水中MX的形成量与氯化处理次数、加氯剂量、TOC浓度呈正相关[10]。为了解饮用水常规处理工艺环节对MX形成的影响,本试验采集武汉市某水厂饮用水常规处理工艺过程中不同工艺阶段的水样,研究其对MX及致突变性的影响,探讨饮水中MX含量增高的主要环节和潜在的健康危害,为城市给水处理工艺的优化提供依据。
1 材料与方法 1.1 材料 1.1.1 试剂MX、二甲基亚砜(DMSO)、XAD-7大孔吸附树脂和总有机碳标准溶液(邻苯二甲酸氢钾1 000 mg/L)(美国Sigma公司);分析纯甲醇,丙酮,乙腈,乙酸乙酯(上海试一化学试剂有限公司),在实验室进行蒸馏纯化;饱和BF3-CH3OH溶液(山东省淄博市临淄鑫强化工有限公司)。
1.1.2 仪器GC3800/MS Saturn 2000气相色谱-质谱联用仪(美国Varian公司);Company Apollo 9000 TOC测定仪(美国Tekmar公司);RE-52AA旋转真空蒸发仪(上海亚荣生化仪器厂);BF 2000氮气吹干仪(北京八方世界科技有限公司);索氏提取器。
1.2 方法 1.2.1 样品采集和浓缩采集武汉市某自来水水厂的源水、预氯后的混凝沉淀水、沉淀水、过滤水、加氯消毒后的出厂水和管网末梢水各100 L。水样立即运至实验室,加盐酸调节pH值至2,用XAD-7树脂吸附,乙酸乙酯:甲醇(4∶1) 洗脱,旋转蒸发仪浓缩,氮气吹干[11, 12],分别用乙酸乙酯和DMSO定容(25 L水样/ml),此即水样有机提取物的储备液,置于-20 ℃冰箱保存。乙酸乙酯定容的水样用于MX分析,DMSO定容的水样用于致突变分析。另采集500 ml水样贮存于棕色瓶中,加盐酸调节pH值至2,直接进行TOC浓度测定。用于浊度和pH分析的水样(2 L)收集于具塞玻璃瓶中,4 h内测定。
1.2.2 MX浓度测定按文献[13]方法进行。
1.2.3 TOC浓度测定(1) 仪器的调试:载气流速:200 ml/min;选定量程:0~20 mg/L;燃烧炉温度:680 ℃。(2) 标准曲线绘制:用三蒸水将总有机碳标准溶液配制成浓度为0.1,0.2,0.5,1.0,5.0,10.0,20.0 mg/L的标准系列进样测定,由吸收峰峰高(峰面积)得出标准系列的总有机碳值并绘制标准曲线。(3) 样品测定:按绘制标准曲线相同的测量条件测定水样吸收峰的峰高(峰面积),每采样点水样检测3次,仪器自动根据标准曲线得出各样品的总有机碳值。(4) 结果分析:对各采样点水样TOC值进行方差分析。
1.2.4 浊度和pH值测定参照中华人民共和国国家标准[14]。水的浊度用分光光度法,pH值用玻璃电极法进行测定。
1.2.5 Ames试验参照文献[15],采用标准平皿掺入法,测试菌株为鼠伤寒沙门菌组氨酸营养缺陷型菌株TA98和TA100。根据文献[16],试验浓度定为4 L/皿,每个水样3个皿平行。致突变结果用突变率表示,突变率(MR)=每皿诱发回变菌落数/每皿自发回变菌落数。试验中,TA98阳性对照用2 μg/ml的敌克松,TA100阳性对照用15 μg/ml的叠氮化钠(NaN3) ,阴性对照为DMSO。
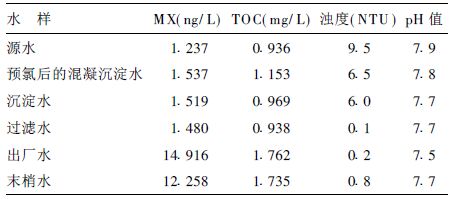
2 结果 2.1 饮用水常规处理工艺过程中MX、TOC、浊度和pH的变化(表 1)| 表 1 不同工艺段水样中的MX和TOC浓度、浊度、pH值 |
在饮用水常规处理工艺过程中,预氯后的混凝沉淀水MX和TOC浓度较源水有所升高,而沉淀工艺则使二者浓度降低,经加氯消毒后的出厂水(包括管网末梢水)中,MX和TOC浓度再次明显上升,且2次加氯后TOC浓度的升高差异均有统计学意义。浊度在水处理工艺过程中呈整体下降趋势,仅管网末梢水略有升高;pH在水处理工艺过程中无明显变化。相关分析表明,各采样点水样中MX的浓度与TOC的浓度呈正相关(r=0.95,P<0.05) ,而与水样的浊度和pH值无相关关系。
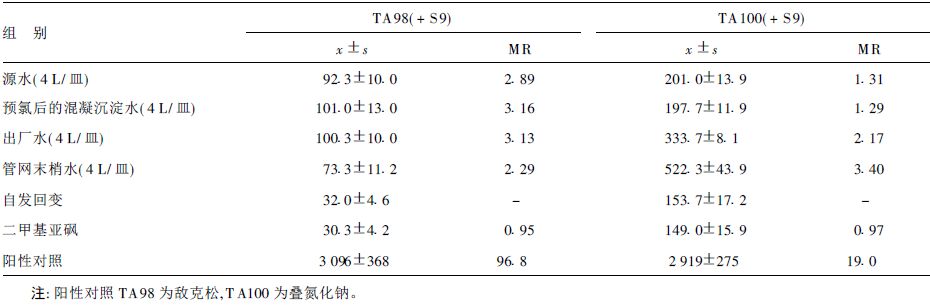
2.2 饮用水常规处理工艺对水样致突变性的影响(表 2)对TA98(+S9,4 L/皿)菌株诱发的致突变性,源水、预氯后的混凝沉淀水、出厂水和管网末梢水MR值均>2;对TA100(+S9,4 L/皿)菌株的致突变性,仅出厂水和管网末梢水的MR值>2。
| 表 2 不同工艺段水样Ames试验结果 |
3 讨论
在常规水处理过程中,经过2次加氯(预加氯和加氯消毒)处理后,MX和TOC浓度明显上升,而沉淀工艺使二者浓度下降,二者呈正相关;出厂水和末梢水中MX和TOC浓度明显高于源水,提示:(1) 2次加氯消毒工艺和沉淀工艺是影响MX和TOC浓度的重要环节;(2) 自来水厂常规水处理过程中水中TOC的含量可能影响MX的生成量;(3) 饮用水经加氯消毒后氯化副产物MX的含量增加。结果还表明,第2次加氯(加氯消毒)较第1次加氯(预氯)使MX含量升高更为明显,为保障管网末梢水的余氯量,加氯消毒时投加的氯量较预氯时增多可能是其主要原因,也证实了氯化处理次数和加氯剂量对氯化消毒副产物MX的生成有影响。
Ames试验结果显示,对TA98的致突变性,源水、出厂水和管网末梢水无差别,而对TA100的致突变性,出厂水和管网末梢水均较源水增加,与DeMarini等的报道一致[17]。提示出厂水和管网末梢水对TA98的致突变性与源水已有的致突变性有关,而与饮用水常规处理工艺没有直接关系;氯化消毒处理可明显增加饮用水对TA100的致突变性。结合文献报道[4]的MX和TA100致突变的关系以及本次试验结果,认为饮用水氯化消毒后致突变性增加与水处理过程中生成氯化消毒副产物MX有关。
| [1] | 王玉鹏, 蒋颂辉, 朱惠刚. S市水质有机物成分分析及遗传毒性研究[J]. 中国公共卫生, 2001, 17(2) : 131–133. |
| [2] | Langvik VA, Hormi O, Tikkannen L, et al. Formation of the mutagen 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone and related compounds by chlorination of phenolic compounds[J]. Chemosphere, 1991, 22 : 547–555. DOI:10.1016/0045-6535(91)90066-M |
| [3] | Smeds A, Vartiainen T, Maki-Paakkannen J, et al. Concentrations of Ames mutagenic chlorohydroxyfuranones and related compounds in drinking water[J]. Environ Sci Tech, 1997, 31(4) : 1033–1039. DOI:10.1021/es960504q |
| [4] | Kronberg L, Vertiainen T. Ames mutagenicity and concentration of the strong mutagen 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone and of its geometric isomer e-2-chloro-3-(dichloromethyl)-4-oxobutenoic acid in chlorine-treated tap water[J]. Mutat Res, 1988, 206 : 177–182. DOI:10.1016/0165-1218(88)90158-9 |
| [5] | Plewa MJ, Kargalioglu Y, Vankerk D, et al. Mammalian cell cytotoxicity and genotoxicity analysis of drinking water disinfection by-products[J]. Environ Mol Mutagen, 2002, 40(2) : 134–142. DOI:10.1002/(ISSN)1098-2280 |
| [6] | 周利红, 刘爱林, 鲁文清, 等. 3-氯-4-二氯甲基-5-羟基-2(5氢)-呋喃酮诱导人胚胎肝细胞ras基因突变[J]. 癌变·畸变·突变, 2006, 5 : 171–174. |
| [7] | Komulainen H, Kosma VM, Vaittinen SL, et al. Carcinogenicity of the drinking water mutagen 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone in rat[J]. J Natl Cancer Inst, 1997, 89(12) : 848–856. DOI:10.1093/jnci/89.12.848 |
| [8] | Nishidawa A, Furukawa F, Lee IS, et al. Promoting effects of 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone on rat glandular stomach carcinogenesis initiated with N-methyl-N'-nitro-N-nitrosoguanidine[J]. Cancer Res, 1999, 59(9) : 2045–2049. |
| [9] | Chen Z, Yang CY, Lu JH, et al. Factors on the formation of disinfection by-products MX,DCA and TCA by chlorination of fulvic acid form lake sediments[J]. Chemosphere, 2001, 45(3) : 379–385. DOI:10.1016/S0045-6535(00)00549-X |
| [10] | Wright JM, Schwartz J, Vartiainen T, et al. 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone(MX) and mutagenic activity in Massachusetts drinking water[J]. Environ Health Perspect, 2002, 110(2) : 157–164. DOI:10.1289/ehp.02110157 |
| [11] | Lu WQ, Chen XN, Yue F, et al. Studies on the in vivo and in vitro mutagenicity and the lipid peroxidation of chlorinated surface(drinking) water in rats and metabolically competent huma cells[J]. Mutat Res, 2002, 513 : 151–157. DOI:10.1016/S1383-5718(01)00307-2 |
| [12] | Kummrow F, Rech CM, Coimbro CA, et al. Comparison of the mutagenic activity of XAD4 and blue rayon extracts of surface water and related drinking water samples[J]. Mutat Res, 2003, 541 : 103–113. DOI:10.1016/j.mrgentox.2003.07.011 |
| [13] | 陆隽鹤, 邹惠仙, 余子锐, 等. 自来水中强致突变物MX的测定[J]. 环境科学, 2002, 2(23) : 123–125. |
| [14] | 生活饮用水标准检测方法感官性状和物理指标[S].GB/T 5750-1985. |
| [15] | Maron DM, Ames BN. Revised methods for the salmonella mutagenicity test[J]. Mutat Res, 1983, 113 : 173–215. DOI:10.1016/0165-1161(83)90010-9 |
| [16] | 唐非, 张水兵, 汪亚州, 等. H江水源水与出厂水中非挥发性有机物致突变性及其化学组分的比较[J]. 环境与健康杂志, 2002, 19(4) : 295–297. |
| [17] | DeMarini DM, Abu-Shakra A, Felton CF, et al. Mutation spectra in salmonella of chlorinated,chloraminated,or ozonated drinking water extracts:comparison to MX[J]. Environ Mol Mutagen, 1995, 26(4) : 270–285. DOI:10.1002/(ISSN)1098-2280 |
 2008, Vol. 24
2008, Vol. 24