2. 德国埃森大学病毒学研究所;
3. 华中科技大学同济医学院附属同济医院临床免疫研究室
由于乙型肝炎病毒(HBV)缺乏体外细胞培养系统,极大地限制了HBV复制机制和抗病毒等方面的研究。常用的HBV细胞模型2.2.15细胞系由于HBV基因整合于细胞染色体,不能形成HBV自然生活周期中至为关键的cccDNA,与病毒自然感染存在很大差异。为此,本研究构建含超长HBV基因组的病毒体外感染性复制子,建立体外瞬时感染细胞模型,对其特性进行初步研究,并在该细胞模型上进行抗病毒研究,以期进一步利用该模型进行HBV的复制和抗病毒等方面的研究。
1 材料与方法 1.1 主要仪器和试剂PCR扩增仪(德国Eppendorf公司);DNA杂交仪(美国Robbins scientific公司);放射显影分析仪(美国PE公司);限制酶AatⅡ、NsiⅠ、BglⅡ、BclⅠ(美国NEB公司);高保真Taq DNA聚合酶(美国Promega公司);质脂体lipofectamine(美国Invitrogen公司)。
1.2 质粒和细菌质粒pHBV-dimer(德国Essen大学病毒学研究所陆蒙吉教授惠赠),该质粒含头尾相连的HBV全基因组双拷贝基因(ayw亚型),即1(EcoRⅠ)-3200/0(EcoRⅠ)-3200(EcoRⅠ)。PCR产物TA克隆载体pCR2.1、感受态细菌TOP10和INV110(美国Invitrogen公司)。
1.3 细胞人肝癌细胞系Huh7为本室保存于液氮中,复苏后培养于含10% 灭活胎牛血清基础培养液(FBS MEM)培养基。
1.4 引物设计根据已知HBV序列合成一对引物P1(1070-1088):5'-GTATACAAGCTAAGCAGGC-3';P2 (1984-1964):5'-TCGAATAGAAGGAAAGAAGTC-3',用于扩增HBV基因1070~1984序列插入到pCR2.1 TA克隆载体。
1.5 1.3基因组倍超长感染性复制子的构建HBV以质粒pHBV-dimer DNA为模板,用引物P1、P2扩增HBV基因1070~1984序列,将其克隆到pCR2.1 TA克隆载体,转化TOP10细菌后挑选阳性质粒测序,选择插入方向为正向的阳性质粒,命名为pHBV0.3。然后用AatⅡ、NsiⅠ双酶切pHBV0.3和pHBV-dimer质粒,将从pHBV-dimer质粒分离的1413(AatⅡ)-3200/0-1064(NsiⅠ) 片段插入pHBV0.3的 AatⅡ和NsiⅠ(NsiⅠ在pCR2.1多克隆位点下游)位点之间,转化INV 110细菌后筛选阳性质粒,命名为pHBV1.0。接着用NsiⅠ、BglⅡ双酶切pHBV-dimer质粒,分离 1064(NsiⅠ)~1984(BglⅡ)片段 ,同时用NsiⅠ、BclⅠ(在pCR2.1多克隆位点下游)双酶切pHBV1.0质粒,将1064(NsiⅠ)~1984(BglⅡ)插入pHBV1.0质粒的NsiⅠ和BclⅠ位点之间,转化TOP10细菌后挑选阳性质粒,用AatⅡ酶切鉴定,命名为pHBV1.3。
1.6 pHBV1.3体外复制和表达Huh7细胞接种于6孔细胞培养板,5×105/孔,培养16 h,待细胞约80%融合时,按说明在5 μl质脂体lipofectamine介导下将5μg pHBV1.3质粒转染Huh7细胞。 37℃、5% CO2培养箱中培养4 d,每天取培养上清ELISA检测HBsAg和HBeAg,并提取细胞总DNA和总RNA,分别用DNA吸印转移法(Southern Blot)和RNA吸印转移法(Northern Blot)检测HBV复制中间体和HBV特异性转录物。
1.7 pHBV1.3质粒一次转染后在Huh7细胞上传代按上述方法转染细胞后,细胞每4 d天传代1次,观察HBV在细胞中复制状况。
1.8 Southern Blot检测染细胞中HBV复制中间体转5 μg转染细胞总DNA在1.5%的琼脂糖凝胶上电泳分离,然后将DNA转印到Hybond-N尼龙膜上,紫外交联后与32P标记的HBV全基因组DNA探针杂交,室温过夜曝光,用放射分析检测仪显影分析杂交结果。
1.9 Northern Blot检测转染细胞中HBV转录物20 μg转染细胞总RNA在1.5%乙二醛琼脂糖变性凝胶上电泳分离,按上述相似方法进行转印和杂交。同时做GAPAH对照,探针为32P标记的纯化GAPAH RT-PCR产物。
1.10 体外抗病毒试验pHBV1.3质粒转染细胞后,在第2 d分别换含不同浓度的阿德福韦(0.01,0.1,1,10 μmol/L)的MEM培养基,再培养72 h,收获细胞提取总DNA用Southern Blot检测HBV复制中间体。
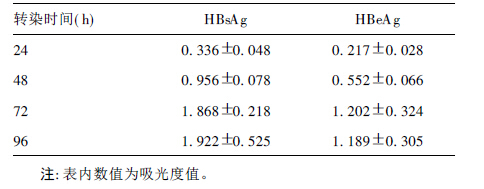
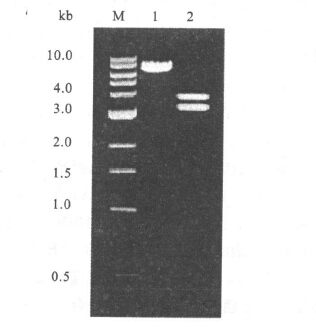
2 结果 2.1 pHBV1.3的构建(图 1)PCR扩增的HBV基因片段1070~1984克隆到pCR2.1 TA克隆载体后,经酶切鉴定后双向测序分析,得到了插入方向为正向的质粒pHBV0.3。AatⅡ和NsiⅠ从pHBV-dimer双酶切1413(AatⅡ)-3200/0-1064(NsiⅠ) 片段插入到pHBV0.3相同的酶切位点,经酶切鉴定得到了pHBV1.0。再通过NsiⅠ、BglⅡ双酶切pHBV-dimer质粒分离 1064(NsiⅠ)~1984(BglⅡ )片段 ,插入到pHBV1.0质粒NsiⅠ与BclⅠ位点之间,获得的质粒经AatⅡ酶切鉴定,可以观察到3200 bp和3856 bp二条带,与预期结果一致,证明成功构建了pHBV1.3质粒。
|
注:M:1kb DNA ladder marker;1:pHBV1.3未酶切;2:pHBV1.3经AatⅡ酶切。 图 1 重组质粒pHBV1.3限制性酶切分析 |
2.2 pHBV1.3转染细胞中HBV的复制特性(表 1,图 2)
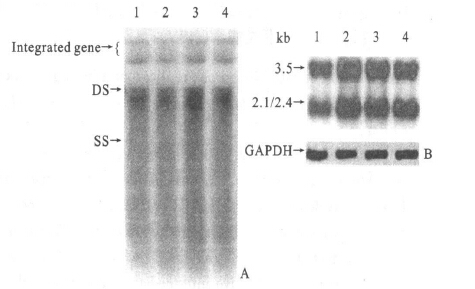
质粒pHBV1.3转染Huh7细胞后,能在Huh7细胞中进行复制,转染24 h培养上清中就能检测到HBsAg和HBeAg,72 h表达达到高峰。核酸杂交能检测到培养细胞中HBV DNA复制中间体和RNA转录物,其水平也在72 h表达达到高峰。
| 表 1 ELISA检测转染细胞培养上清液HBsAg和HBeAg结果 |
|
图 2 核酸杂交检测转染细胞内HBV DNA复制中间体和病毒特异性转录物 |
2.3 pHBV1.3转染细胞中病毒的传代
转染细胞每4 d传代一次,Southern Blot检测HBV体外复制状况,发现能传3代,共12 d,可以检测到HBV复制中间体;至第4代共16 d时已检测不到HBV复制中间体。
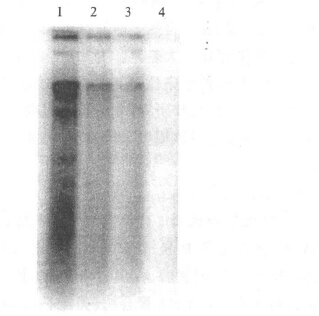
2.4 体外抗病毒试验(图 3)pHBV1.3表达质粒转染Huh7细胞后,发现用不同浓度阿德福韦处理细胞可以抑制HBV的复制,并且抑制程度依赖于药物的处理浓度,10 μmol/L阿德福韦能完全抑制HBV在Huh7细胞中的复制。
|
图 3 HBV复制子对阿德福韦敏感性 |
3 讨论
近年来,有学者将HBV多倍体基因组转染肝细胞用于HBV的相关研究,由于HBV最长的转录子是长约3.5kb RNA,所以要使HBV在细胞内复制,构建最多的是含HBV 基因组DNA 2.0,1.3,1.2和1.1拷贝的各种表达质粒。因为1.3拷贝含HBV完整复制体,基因组小于2.0拷贝,且复制和表达效率高于1.2和1.1拷贝[1],包含了HBV 5'末端EnhⅠ、 EnhⅡ,复制起始区(DR1、DR2)、前基因组转录起始位点、各启动子和开放读码框等,所以应用的最多。本研究以pHBV-dimer质粒为基础构建1.3拷贝HBV感染性复制子,充分利用HBV基因组DNA和TA克隆载体pCR2.1的特异性酶切位点,采用了PCR结合双酶切的方法,成功构建了含HBV全基因组1.3拷贝的HBV体外复制子。第2次双酶切pHBV-dimer和pHBV1.0质粒时,本研究分别应用了BglⅡ和BclⅠ作为下游酶切位点,因为pHBV1.0不能再用BglⅡ,否则会切乱载体上已有的HBV基因,但BclⅠ(TGATCA)切下的载体能使BglⅡ(AGATCT)切下的目的基因插入。BclⅠ对dam甲基化敏感,普通细菌都有dam甲基化酶,使GATC序列甲基化为GMATC,所以本研究使用了无dam甲基化酶的感受态细菌INV110转染和扩增pHBV1.0质粒。
本研究所构建的重组表达质粒pHBV1.3转染Huh7细胞后,HBV基因能在体外进行复制和表达,能检出HBsAg、HBeAg和HBV DNA复制中间体、转录子,并且都有很高的水平。转染细胞体外传代试验表明HBV仅能在转染细胞传代3次,说明连续的细胞传代因为细胞不断分裂增殖,会使细胞内病毒逐渐流产消失,这也表明HBV的体外复制能力有限。同时本研究在所建立的细胞模型上进行了初步的抗病毒研究,近年开发的新型核苷类抗乙型病毒性肝炎药物阿德福韦可[2, 3]有效地抑制HBV细胞内增殖,表明该HBV复制细胞模型系统可以进一步应用于体外抗病毒药物筛选。
| [1] | Guidotti LG, Matzke B, Schaller H, et al. High-level hepatitis B virus replication in transgenic mice[J]. J Virol, 1995, 69 : 6158–6169. |
| [2] | Marcellin P, Chang TT, Lim SG, et al. Adefovir dipivoxil for the treatment of hepatitis B antigen-positive chronic hepatitis B[J]. N Engl J Med, 2003, 348 : 808–816. DOI:10.1056/NEJMoa020681 |
| [3] | Hadziyannis SJ, Tassopoμlos NC, Heathcote EJ, et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-negative chronic hepatitis B[J]. N Engl J Med, 2003, 348 : 800–807. DOI:10.1056/NEJMoa021812 |
 2008, Vol. 24
2008, Vol. 24