2. 中国医科大学免疫学教研室
2. Department of Immunology and Microbiology, Liaoning Medical University Jinzhou121000, China
T细胞可分别表达2种不同类型的T细胞抗原受体(TCR),一种称为TCRαβ;另一种称为TCRγδ。表达TCRγδ-CD3复合物的T细胞称为γδT细胞。最近研究发现,结核杆菌的急性感染患者外周血γδT细胞数量明显增高,而慢性活动性结核病患者的迁延不愈与其数量显著降低密切相关。另外,γδT细胞缺陷的小鼠感染结核杆菌后,生存时间明显缩短[1],说明γδT细胞在抗结核杆菌感染中可能起着重要作用,也提示结核杆菌抗原对γδT细胞有刺激增殖的作用。本实验采用结核杆菌水浴灭活后经超声破碎获得的产物在体外与外周血单个核细胞共培养,以观察Mtb-Ag对γδT细胞的影响,寻求更好的体外扩增γδT细胞的可行方法,解决医学研究中γδT细胞来源不足的问题。
1 材料与方法 1.1 材料(1)试剂:抗TCR-γδ-FITC、抗TCR-αβ-PE及rIL-2(美国Bioscience公司)RPMI-1640培养液、淋巴细胞分离液(美国Gibco公司);四甲基偶氮噻唑蓝(MTT)、小牛血清、丙酮酸钠等(北京晶美公司);Mtb-Ag(实验室自行制备)。(2)仪器:CO2恒温培养箱E191TC(美国西盟公司);倒置显微镜Olympus CK-TX-2(日本奥林巴斯公司);流式细胞仪FACS Calibuf(美国Becton-Dickinson公司);酶联免疫检测仪DG3022A(上海围营华东电子管厂);超声波细胞破粉碎机JYP2-II(宁波新芝生物科技股份有限公司)。
1.2 方法 1.2.1 结核分枝杆菌的分离培养及扩增肺结核病人于清晨漱口后,取深部咳痰标本加4%氢氧化钠消化。吸取处理后的痰液0.1ml,均匀接种在整个酸性改良罗氏培养基斜面,37℃培养。接种后第4周发现细小颗粒状菌落,抗酸染色显示阳性后,接种至丙酮酸钠液体培养基(在丙酮酸钠固体培养基基础上略有改进)中进行扩增2周。
1.2.2 Mtb-Ag的制备将丙酮酸钠液体培养基扩增产物置于离心管内,4500r/min离心,30min,弃上清,加入磷酸盐缓冲(PBS)液,洗涤3次后称重。85℃水浴灭活20min,用超声波细胞破碎仪80W,2h破碎后,4 500r/min,离心30min,取上清,用0.22μm滤膜过滤后,调整蛋白浓度为500μg/ml,-20℃冰箱保存,备用。
1.2.3 外周血单个核细胞(PBMC)的分离取静脉抗凝血10ml,用pH7.3~7.6Hanks溶液按1:1稀释。取淋巴细胞分离液常规分离外周血单个核细胞。PBMC经PBS洗涤3次后。用RPMI1640完全培养液调整细胞浓度至1×106/ml,按每孔2ml加入24孔培养板中。
1.2.4 Mtb-Ag刺激培养实验共分4组:(1)5μg/ml Mtb-Ag+50U/ml rlL-2;(2)7μg/ml Mtb-Ag+50U/ml rIL-2;(3)9μg/ml Mtb-Ag+50U/ml rIL-2;(4)对照组50U/ml rIL-2。置于37℃、5%CO2恒温培养箱中进行培养,于培养的第3,6和9d,各孔补加rIL-2(50U/ml)以维持细胞生长。
1.2.5 指标测定1.2.5.1 MTT比色法检测增殖程度 分别乎第3,6和9d检测增殖程度。取200μl上述细胞加入40孔细胞培养板中,每孔加入MTT溶液(5 mg/ml)20μl,37℃孵育4h。1000r/min离心5min,弃去培养液,每孔加入150μl二甲基亚砜(DMSO),震荡10min,使 formazan充分溶解。在酶标仪上测定吸光度(A)值,测定波长为570nm[2]。
1.2.5.2 流式细胞仪检测 将收集的细胞用冷PBS缓冲液(含5%FCS、0.1%NAN3)1500r/min,5min洗涤2次。调整细胞浓度为1×106个细胞/ml,取各组细胞100μl,分别加入抗TCR-γδ-PE或抗TCR-αβ-FITC抗体各10μl,置4℃避光30min,用PBS洗涤2次,加入含1%多聚甲醛的PBS悬浮并固定细胞。流式细胞术(FCM)检测细胞百分率。
1.3 统计分析采用SPSS 11.5统计软件进行分析。组间差异用方差分析,组内差异用t检验。
2 结果 2.1 结核杆菌分离培养及扩增的结果酸性改良罗氏培养基培养4周时抗酸染色镜下观察到细长、略带弯曲的红色杆菌,单个存在或聚集排列,有的呈分枝状。丙酮酸钠液体培养基培养2周时可见培养基颜色变淡,底部有颗粒状物质沉积,摇晃后可悬浮。
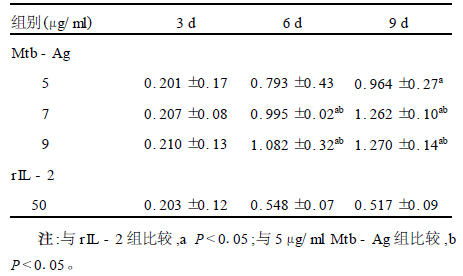
2.2 PBMC的增殖动态(表 1)以rIL-2单独刺激PBMC时,细胞培养2d后开始增殖加快,培养8d后增殖减慢;Mtb-Ag各刺激组刺激PBMC时,前4d细胞增殖缓慢,随后细胞增殖加快,培养9d时增殖活动仍很强。不同刺激剂量的Mtb-Ag对PBMC增殖的影响有所不同,在一定范围内随着刺激剂量的增加PBMC增殖亦增加,但7μg/ml以上时,差别并不显著。
| 表 1 不同剂量和不同时间的吸光度(A)值( n = 4 , x ±s) |
2.3 增殖细胞的表型分析(表 2)
应用流式细胞仪检测γδT细胞和αβT细胞的增殖比率。新鲜分离的PBMC中,γδT细胞比率约为(4±2.35)%。各组选择培养9d时,rIL-2刺激组增殖细胞中γδT细胞的增殖比率仅为7.59%,而γδT细胞的增殖比率高达58.33%。Mtb-Ag的剂量由5μg/ml增加到7μg/ml时,γδT细胞和αβT细胞的增殖比率也增加。当刺激剂量增加至9μg/ml时,γδT细胞增殖比率开始降低,而αβT细胞增殖比率增加明显。
| 表 2 不同刺激组PBMC培养9d增殖细胞表型分析 |
3 讨论
本实验结果显示,标本抗酸染色阳性后,特配制以丙酮酸钠、小牛血清等为主要成分的液体培养基,37℃进行扩增。由于细菌在液体培养基中同营养物接触面广,增殖加快,经10~14d培养后肉眼观察到培养基颜色变淡,底部有大量颗粒状物质沉积,取沉淀物抗酸染色,结果为阳性。说明丙酮酸钠液体培养基可明显缩短培养时间和提高结核杆菌的产量。
本实验中以5,7和9μg/ml 3种浓度的Mtb-Ag刺激PBMC的结果显示,在7μg/ml以下时PBMC增殖程度与Mtb-Ag的剂量呈正相关,而9μg/ml浓度对PBMC增殖的影响与7μg/ml浓度差异无统计学意义(P>0.05),说明Mtb-Ag对PBMC增殖的有效刺激剂量可能在7~9μg/ml之间。进一步分析结果表明,Mtb-Ag在不同刺激剂量对人γδT细胞和αβT细胞具有一定的选择激活效应。但从量效关系上分析显示,7μg/ml Mtb-Ag I刺激组,γδT细胞表现出优势扩增,αβT细胞增殖比率则较低;但当刺激剂量增加至9μg/ml时,γδT细胞的增殖比率开始降低,而αβT细胞增殖比率则明显增加,表现出对αβT细胞的优势扩增。出现上述结果的可能原因是与Mtb-Ag在低剂量时可激活γδT细胞,促进γδT细胞的增殖;而在大剂量时可激活αβT细胞,促进αβT细胞的增殖。但要分清活化不同T细胞亚群的具体成分还需进一步研究。
| [1] | Ordway DJ, Pinto L, Costa L, et al. Gamma delta T cell responses associated with the development of tuberculosis in health care workers[J]. FEMS Immunol Med Microbiol, 2005, 43(3) : 339–350. DOI:10.1016/j.femsim.2004.09.005 |
| [2] | 潘兴瑜, 付京晶, 薛欣, 等. MTT比色法改进的研究[J]. 中国免疫学杂志, 1999, 15(12) : 559. |
 2008, Vol. 24
2008, Vol. 24