增强免疫力是指通过外来干预手段,增强人体免疫力的举措。由于具有增强免疫力功能的产品多用于免疫水平较低的人群,用免疫低下动物模型进行评价更接近实际情况[1, 2]。流式细胞术分析T 淋巴细胞和自然杀伤细胞( NK) 等细胞免疫功能具有快速、多参数、可定量、操作简便等优点,国外已有较多报道[3, 4]。本文拟以环磷酰胺为造模剂建立一套小鼠免疫功能低下模型,结合双色荧光标记、流式细胞术检测外周血T 淋巴细胞CD69+ / CD3+、外周血NK 淋巴细胞CD69+ / 自然杀伤细胞G2D 受体(NKG2D+) 表达情况,观察环磷酰胺对小鼠细胞免疫功能的影响,为免疫调节评价体系中动物模型的选择提供参考依据。
1 材料与方法 1.1 材料 1.1.1 实验动物和实验室SPF 级Balb/ C 种雌性小白鼠24只,6~ 8 周龄,体重16~ 20g( 第一军医大学医用动物场) 合格证书号2003A046。动物实验室: SPF 级,合格书粤检证号2001C059,室温( 22± 2) e ; 湿度50%~ 75%。
1.1.2 仪器和试剂流式细胞仪( FACS Calibur,美国Bec2ton Dickinson 公司) ; 全自动酶标仪( 芬兰Labsystems 公司) ; 环磷酰胺( 上海华联制药有限公司,批号: 001106) ;NP240 ( 德国Fluka 公司,批号: 2000/ 01) ; NKG2D( 藻红蛋白标记,Cat: E008303) ; CD3 用磷脂酰乙醇胺荧光素标记( PE) 、CD69 用( 异硫氰酸荧光素标记FITC,Cat- E004450) ; 单克隆抗体、同型对照以及溶血素( 美国Phar Mingen 公司) 刀豆球蛋白A ( ConA) ( 美国Worthington Biochemical 公司,批号:50K904J) ; 四甲基偶氮噻唑蓝( MTT) ( 美国Biotec 公司,批号: BS0887) ; 2% 和20% 绵羊红细胞( SRBC) 悬液自行制备( 生理盐水洗涤3 次,2 000 r/mim 离心5min) 。
1.2 方法 1.2.1 模型分组按体重随机分组方法,将40 只健康小鼠随机均分为4 组: 正常对照组( N S 组) 、模型A、B、C 组,每组10 只。( 1) 正常对照组( NS 组) 给予生理盐水。( 2) 模型A组: 采用环磷酰胺80mg/ kg 剂量连续注射3 d,造成相应免疫低下,再以一定周期( 每周相同剂量) 适时强化1 次。( 3) 模型B 组: 采用环磷酰胺1 次大剂量( 100 mg/ kg) 注射造成免疫低下,不再强化。( 4) 模型C 组: 采用环磷酰胺小剂量( 40 mg/kg) 连续注射30 d 造成免疫低下,于第1 次给予环磷酰胺后30 d 检测相应指标。
1.2.2 小鼠外周血T 淋巴细胞亚群CD69+ / CD3+比值检测[5]摘除小鼠眼球,立即取50 Ll 肝素抗凝血与4 LlCD3( 磷脂酰乙醇胺荧光素标记,PE) 单抗和9Ll CD69( 异硫氰酸荧光素标记,FITC) 单抗混合,室温下避光孵育30 min,用015 ml溶血素准确裂解红细胞10 min,1 300 r/ min,离心5 min 获取有核细胞,用磷酸盐缓冲液( PBS) 洗涤2 次后用流式细胞仪分析,标记的细胞经前向散射(Forward scarer ,FSC) 和侧向散射(Side scatter,SSC) ,在二维Dot- Plot 图中划出淋巴细胞区,然后对淋巴细胞进行FITC 和PE 荧光强度检测,其中FITC 为荧光1(FLl) ,滤光片带通为( 530 ± 115) mm,PE 为荧光2( FL2) ,滤光片带通为( 585 ± 21) hm,数据显示于双色散点图(FLI 与FL2) 中。测定时各荧光通道均以相同类型( lso2type) I gG 染色作为同型对照,计数10 000 个淋巴细胞,经FACS Calibur 流式细胞仪及CellQuest 软件获取和分析。
1.2.3 小鼠脾T 淋巴细胞亚群CD69+ / CD3+比值检测处死小鼠后,无菌取出脾脏,放入115 mlPBS 液中研磨,200 目不锈钢网过滤,将脾细胞调成5@105/ ml 的单细胞悬液后,取50 gl 细胞悬液与4 Ll CD3( PE) 单抗和9 Ll CD69( FIT C) 单抗混合,避光孵育,溶血,离心,洗涤,用流式细胞仪分析。
1.2.4 小鼠外周血NK 细胞亚群CD69+ / NKG2D+比值检测[7]摘除小鼠眼球,立即取50 Ll 肝素抗凝血与215 LlNKG2D 单抗和1Ll CD69 单抗混合,室温下避光孵育30min,用01 5ml 溶血素准确裂解红细胞10 min,离心,洗涤,用流式细胞仪分析。
1.2.5 小鼠脾NK 细胞亚群CD69+ / NKG2D+比值检测[7]处死小鼠后,无菌取出脾脏,放入11 5 ml PBs 液中研磨,200目不锈钢网过滤,将脾细胞调成5@105/ ml 的单细胞悬液后,取50 Ll 细胞悬液与215 Ll NKG2D 单抗和1 Ll CD69 单抗混合,避光孵育,溶血,离心,洗涤,用流式细胞仪分析。
1.2.6 小鼠脾NK 细胞活性测定( LDH 法)参照文献[1]方法按以下分式计算NK 细胞活性。NK 细胞活性%= ( 反应孔A- 自然释放孔A) / ( 最大释放孔A- 自然释放孔A) @100,NK 细胞活性转换值: X= Sin- 1( P) 1/ 2。
1.2.7 ConA 诱导的小鼠脾淋巴细胞转化试验( 四甲基偶氮噻唑蓝法,MTT 法)参照文献182方法,在酶标仪570 nm 波长处测定吸光度( A) 值,以加ConA 孔的吸光度值减去不加CortA 孔的吸光度值代表淋巴细胞的增殖能力。
1.3 统计分析采用SPSS101 0 统计软件进行t检验和单因素方差分析。
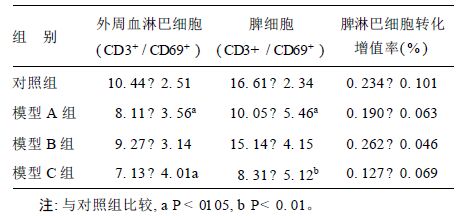
2 结 果 2.1 环磷酰胺对T 淋巴细胞影响( 表 1) 2.1.1 环磷酰胺对T 淋巴细胞CD69+ / CD3+检测结果从表 1 可见,环磷酰胺模型A、C 组外周血和脾的T 淋巴细胞比例CD69+ / CD3+较阴性对照组降低,提示环磷酰胺强化注射、少量多次注射造模可降低小鼠T 淋巴细胞CD69、CD3 的表达。
| 表 1 环磷酰胺对小鼠脾淋巴细胞转化反应的影响( x±s) |
2.1.2 环磷酰胺对T 淋巴细胞转化增殖能力检测结果
从表 1 可见,环磷酰胺模型A、C 组T 淋巴细胞转化增殖能力较阴性对照组降低,提示环磷酰胺强化注射、少量多次注射造模有降低小鼠T 淋巴细胞转化增殖能力的作用。
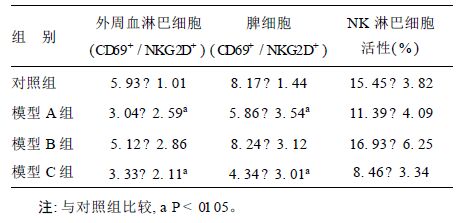
2.2 环磷酰胺对NK 细胞影响( 表 2) 2.2.1 环磷酰胺对NK 细胞影响从表 2 可见,环磷酰胺对NK 细胞CD69+ / NKG2D+检测结果,环磷酰胺模型A、C 组外周血和脾活化的NK 细胞比例( CD69+ / NKG2D+) 均较阴性对照组明显降低,提示环磷酰胺强化注射、少量多次注射造模可降低小鼠NK 细胞CD69、NKG2D 的表达。
| 表 2 环磷酰胺对小鼠NK 细胞活性的影响( x± s) |
2.2.2 环磷酰胺对NK 细胞活性的影响
从表 2 可见,环磷酰胺模型A、C 组NK 细胞活性较阴性对照组均降低,提示环磷酰胺强化注射、少量多次注射造模有降低小鼠NK 细胞活性的作用。
3 讨 论目前常用的化学造模剂有环磷酰胺、氢化可的松、地塞米松、环孢菌素A、放线菌素、长春新碱等。环磷酰胺因其是常用的肿瘤化疗药之一而应用最广。有文献报道,环磷酰胺模型多采用一次大剂量给药的方式造模[8]。本研究结果表明,一次较大剂量造模、适时强化的方法,不仅能有效降低免疫功能,且操作简便,适用于建立长期免疫低下横型。
外周血T 细胞亚群是公认的反应细胞免疫状态较好的指标[9]。CD3 是外周血中代表成熟T 淋巴细胞最好标志物之一[10]。NK 细胞被认为是机体天然免疫的第一道防线,起到连接非特异性免疫和特异性免疫的桥梁作用[11]。其抑制受体主要包括杀伤细胞免疫球蛋白受体( KIR) 和CD69/NKG2D 复合体1122。细胞分化抗原CD69 作为一种早期激活抗原,在体外实验中是一个好的活化细胞的标忐物1132。流式细胞术现广泛应用于探讨机体免疫反应以及机体免疫调节的影响,被认为是血液中淋巴细胞表型分析的标准方法[14-16] 。本研究采用流式细胞术进行免疫低下模型的T 淋巴细胞和NK 细胞分化抗原检测。结果显示,T 淋巴细胞比例(CD69+ / CD3+) 、NK 细胞比例( CD69+ / NKG2D+) 与传统指标T 淋巴细胞转化增殖能力、NK 细胞活性具较好一致性,说明这项指标具有敏感性强、有效性高的特点,可用于快速、简便而有效地评价细胞免疫功能,在免疫功能学评价中有较好的应用价值。
| [1] | 卢宇, 李百祥, 刘家仁. 大豆皂甙对环磷酰胺所致小鼠免疫失衡 的保护作用[J]. 军事医学科学院院刊, 2003, 27(1) : 44–46. |
| [2] | 张蕾, 郭红卫, 吴岷. 建立小鼠免疫功能低下模型的研究[J]. 环 境与职业医学, 2003, 20(2) : 95–98. |
| [3] | Mut ter L, Muier G Bochit er R, et al. Flow cytometry as a sensit ive tool to assess t esticular damage in rat e[J]. Rchi Toxlcol, 1998, 72(3) : 791–797. |
| [4] | Galen LJ, Darling D, Gan SU, et al. Expression of a variant of CD28 on a subpopulat ion of human NK cells: implicat ions for B72 mediat ed stimulat ion of NK calls[J]. J Immunol, 1999, 16(3) : 62–70. |
| [5] | 黄琼, 杨杏芬, 黄俊明. CD69/ CD3 比值和左旋咪唑对照在评价 保健食品免疫调节作用中的应用研究[J]. 中国卫生检验杂志, 2004, 14(1) : 42–44. |
| [6] | 黄琼, 李志, 黄健康. CD69/ NKG2D 比值在保健食品评价中的 应用[J]. 中国公共卫生, 2005, 21(9) : 1095–1096. |
| [7] | 保健食品检验与评价技术规范[ S] . 卫生部卫法监发[ 2003] 42 号. |
| [8] | 赵戈清, 罗辉, 陈东辉. 小同剂量环磷酰胺诱导正常小鼠免疫抑 制的研究[J]. 免疫学杂志, 2005, 21(3) : 122–124. |
| [9] | 窦肇华, 张远强, 郭顺根. 免疫细胞学与疾病[M]. 北京: 中国医 药科技出版社, 2004: 30-31. |
| [10] | 王自正. 现代标记免疫学[M]. 北京: 人民军医出版社, 2000: 79-81. |
| [11] | Dogli L, Espost i MA, Smyth MJ. Close encount er of different kinds: dent ritic cells and NKcells t ake cent er stage[J]. Nature Rev Immunol, 2005, 5(2) : 112. DOI:10.1038/nri1549 |
| [12] | Cooper MA, Fehn iger TA, Callgiuri MA. T he biology of human natural k iller cell subset s[J]. Trends Immunol, 2001, 22(1) : 633. |
| [13] | Zmgoni A, Palml eri G, Morroni S, et al. CD69 triggered ERK act i2 vation and funct ion are negt ively regulated by CD94/ NKG22A in2 hibitory receptor[J]. Eur Immunol, 2000, 30(4) : 644–651. |
| [14] | 于建中. 临床流式分析[M]. 上海: 上海科技出版社, 2006: 61-62. |
| [15] | Lissioni P, Brovio F, Ferrante R, et al. Circulat ing immature and mature dendrit ic cell in relationto lymphocyte subset s in pat ient s with gast roint estinal t ract cancer[J]. Int J Boil Markers, 2000, 15(1) : 22–25. |
| [16] | 沈玉光, 许金良, 杨宗林, 等. 流式细胞术测肺癌患者外周血T 细胞亚群及其临床病理的关系[J]. 实用诊断与治疗杂志, 2006, 2(2) : 101–104. |
 2008, Vol. 24
2008, Vol. 24