2. 中国医科大学附属第一临床医院信息中心;;
3. 沈阳医学院奉天医院儿科
膳食脂肪对易感基因的作用越来越受到重视。酵母染色质沉默因子1( silent info rmat ionregulator 1,Sirtl) 编码的核蛋白参与多种新陈代谢活动,以往人们对Sir tl 的研究多集中在与能量限制有关的长寿领域[1, 2]。为了解Sir tl 与肥胖之间的关系,本研究利用高脂饮食诱导产生肥胖倾向和肥胖抵抗动物模型,比较高脂肪高能量条件对Sirtl 基因表达的影响,为探索新的肥胖防治途径提供科学依据。
1 材料与方法 1.1 实验动物选取健康断乳雄性Wistar 幼年大鼠30 只( 中国医科大学实验动物部) ,初始体重为( 114.6± 9.4) g。生活环境为自然光照,温度18~ 22℃ ,相对湿度为50'~ 60'。
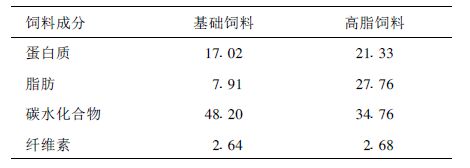
1.2 动物饲料配方及主要成分( 表 1)基础饲料由中国医科大学实验动物部提供,能量密度为1 500 kJ/ 100 g ; 高脂饲料为自行配制,能量密度为2 010 kJ/ 100 g。
| 表 1 基础饲料高脂饲料营养成分对比( g/ 100g) |
1.3 动物的分组与饲养
大鼠单笼喂养,适应性喂养1 周,随机按体重分为高脂组和对照组,20 只高脂组大鼠给予高脂饲料,10 只对照组大鼠给予正常饲料,2 组动物均自由进食水,每日纪录体重和进食量,喂养4 周。
1.4 肥胖倾向( OP) 与肥胖抵抗( OR) 鼠的判定实验结束时高脂组按体重由高至低排序,体重位于上游的前1/ 3( 7 只)大鼠判定为肥胖倾向大鼠,体重位于下游的后1/ 3( 7 只) 大鼠判定为肥胖抵抗大鼠[3]。
1.5 采用RT- PCR 方法比较SirtlmRNA 表达水平动物乙醚麻醉后断头处死,剖开腹部,剥离全部附睾周、肾周脂肪垫并称重,另取少量腹部皮下脂肪组织,迅速于- 70℃ 冻存待测。RT- PCR 试剂盒( 购于TakaRa 大连宝生物工程有限公司) 。引物序列( 大连联星生物技术有限公司合成) : Sirt 1 为Forward 5'TTGGCACCGATCCTCGAAC3',Reverse 5'CCCAGCTCCAGTCAGAACTAT3';β-actin 为Forward 5'TCACTATCGGCAATGTGCGG3',Reverse5'GCTCAGGAGGAGCAATGATG3'; Sir tl 与β-actin的PCR 反应条件: 95℃ 2min; 94℃ 30 s,55℃ 40 s,72℃ 35 s,30 个循环,延伸72℃ 10s。1.5'琼脂糖凝胶电泳,Bio- Rad 凝胶成像分析系统扫描以及分析电泳条带密度值,以β-actin为内参照,计算Sirtl 基因的相对含量。
1.6 统计分析采用SPSS 13 0 软件进行数据处理。结果以x± s 表示,组间比较采用方差分析,组间两两比较采用Bonferroni 法,以P< 0. 05 为检验水准。
2 结 果 2.1 高脂饲料对大鼠体重的影响实验干预开始时,3 组间体重差异无统计学意义。喂养1 周后,高脂饲料喂养的大鼠间体重出现分化,按照OP 与OR 鼠的判定原则,OP 鼠体重已显著高于OR 鼠( P< 0. 05) 。OP 鼠体重增长速度明显高于对照组大鼠,而OR 鼠体重增长速度明显低于对照组。在喂养23 d 后,3 组间体重差异都有统计学意义( P< 0.05) ,这种差异一直保持至实验结束。
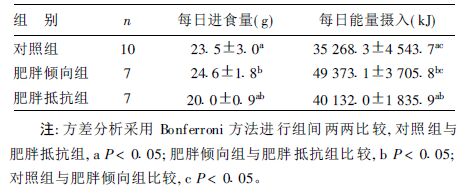
2.2 高脂饲料对大鼠进食量与能量摄入的比较( 表 2)| 表 2 3 组大鼠平均每日进食量与能量摄入比较( x ± s) |
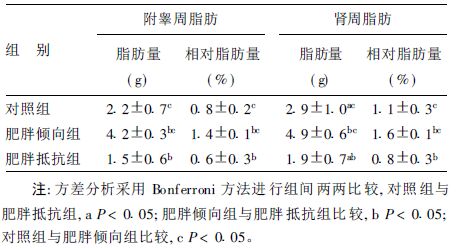
2.3 高脂饮食诱导体脂肪生长情况( 表 3)
| 表 3 3 组大鼠体脂肪含量比较( x ± s) |
2.4 高脂饮食对皮下及内脏白色脂肪组织Sirtl mRNA 表达水平的影响( 图 1)
比较皮下及内脏白色脂肪中Sirtl mRNA的表达水平,肥胖倾向与肥胖抵抗组的Sirtl mRNA 表达水平差异无统计学意义( P > 0.05) ,并且都显著低于对照组( P<0.05) 。

|
注: M 分子量marker, OR 肥胖抵抗组,OP 肥胖倾向组, Con 对照组 图 1 高脂饮食对白色脂肪组织Sirtl mRNA 表达水平的影响 |
3 讨 论
在自由进食状态下,3 组间每日能量摄入的差别造成体重增长不同。同样自由进食传统高脂饲料,OP 大鼠与OR 大鼠平均每日能量摄入有明显差异,原因之一可能在于OP 大鼠中枢内与摄食和代谢相关的多肽一神经肽Y 的水平高[4]、自发性体力活动量少以及非锻炼性活动生热增加不足有关[5, 6]。
实验结果表明,尽管OR 大鼠比对照组每日摄入更多的能量,但实验结束时体重和内脏脂肪的含量却显著低于对照组,可能由于诱导时间足。Levin[3]发现,OR 大鼠进食高脂饮食时间变长时,它们也会变成肥胖大鼠。然而OR 大鼠不会维持自己的高体重,当由高脂饲料转变为正常饲料时肥胖的OR 大鼠会自动限制饮食,直到它们的体重同正常的OR 大鼠一样。可是OP 大鼠当由高脂饲料转变为正常饲料时,体重仍会保持数月之久。
本实验结果显示,喂以高脂饲料的肥胖倾向和肥胖抵抗大鼠在皮下和内脏的白色脂肪处Sir tl mRNA 表达的组间比较差别不大,但都显著低于对照组,表明高脂饮食干预制造的高脂肪高能量负荷对大鼠脂肪组织Sirt1 的表达有抑制作用,提示Sir t1 基因可以作为调控体脂肪含量的靶基因。
| [1] | Anastasiou D, Krek W. SIRT 1: linking adapt ive cellular responses t o aging-associat ed changes in organismal physiology[J]. Physiology, 2006, 21 : 404–410. DOI:10.1152/physiol.00031.2006 |
| [2] | Bordone L, Guarent e L. Calorie rest rict ion, SIRT 1 and metabolism: underst anding longevit y[J]. Nat Rev Mol Cell Biol, 2005, 6(4) : 298–305. DOI:10.1038/nrm1616 |
| [3] | Levin BE. Arcuat e NPY neurons and energy hom eost asis in dietinduced obese and resistant rat s[J]. Am J Physiol, 1999, 276(2) : 382–387. |
| [4] | Levin BE, Dunn-Meynell AA. Dysregulat ion of arcuat e nucleus preproneuropept ide Y mRNA in diet-induced obese rat s[J]. Am J Physiol, 1997, 272(4) : 1365–1370. |
| [5] | Jang I, Hw ang D, Lee J, et al. Physiological diff erence betw een di?? et ary obesit y-susceptible and obesit y-resistant Sprague Daw ley rat s in response t o moderat e high fat diet[J]. Exp Anim, 2003, 52(2) : 99–107. DOI:10.1538/expanim.52.99 |
| [6] | Novak CM, Kotz CM, Levine JA. Cent ral orexin sensit ivit y, physi?? cal activity, and obesity in diet-induced obese and diet-resist ant rat s[J]. Am J Physiol Endocrinol Met ab, 2006, 290(2) : 396–403. |
 2008, Vol. 24
2008, Vol. 24