研究表明,在一些细菌中存在主动外排现象,即细菌能将扩散进细胞内的多种结构不相关的抗生素药物主动泵出细胞外,从而使细菌获得耐药性。研究较多的是大肠埃希菌AcrAB-TolC耐多药外排泵[1-3],已证实该泵在志贺菌属细菌中也有存在,且对志贺菌耐多药起重要作用[4]。acrAB的表达受多种调节因子的调节,最主要的为AcrR抑制子与耐多药(mar)操纵子。本文观察调控基因acrR、marOR的突变与志贺菌耐多药之间的关系,为防治志贺菌耐多药产生提供依据。结果报告如下。
1 材料与方法 1.1 材料(1) 菌株与抗生素:志贺菌临床分离株56株(分离自河南郑州三所医院的腹泻患者粪便),质控菌为ATCC2922。四环素、氯霉素、氨苄青霉素、环丙沙星、诺氟沙星等5种抗生素药敏纸片(北京天坛药物生物技术有限公司),PCR及酶切试剂(北京赛百胜基因技术有限公司)。acrR基因引物序列A1:5'-AAG TCG GAT TTG TTC AGT G-3',A2:5'-ATT CGT TAG TGG CAG GAT-3';marOR基因引物序列B1:5'-CAC TCT TTA GCT AGC CTT G-3',B2:5'-TGG ACA TCG TCA TAC CTC T-3'。引物合成由赛百胜生物公司完成。
1.2 1.2 方法 1.2.1 耐多药株和敏感野生株筛选药物敏感试验采用Kinby-Bauer纸片琼脂扩散法,按照美国国立临床实验室标准委员会(NCCLS)指南进行。对实验室收集的56株志贺菌进行筛选,以耐四环素、氯霉素、氨苄青霉素、环丙沙星或诺氟沙星的菌株为耐多药株(Mar),对5种抗生素均敏感的为敏感野生株(wild type,WT)。志贺菌对上述5种抗生素的耐药与敏感根据NCCLS颁布的1997年药敏试验法规标准判读。
1.2.2 志贺菌acrR,marOR基因检测煮沸法提取模板DNA。PCR扩增acrR,marOR基因,PCR扩增体系为50 l,三蒸水34 l,10×PCR反应缓冲液5 l,dNTPs 1 l,10 mol/L引物各1.5 l,模板DNA 8 l,5 u/l Taq酶0.5 l。94℃ 变性5 min,PCR循环参数为:94℃ 50 s,51℃ 40 s,72℃ 60 s共30个循环,最后72℃ 延伸600 s。
1.2.3 志贺菌acrR,marOR基因单链构象多态性(SSCP)分析采用TaqI限制性内切酶消化acrR与marOR扩增产物,酶切产物变性后进行8%聚丙烯酸胺凝胶电泳,硝酸银染色后观察结果并照相。
2 结果 2.1 菌株筛选与PCR扩增56株志贺菌临床分离株,计筛选出耐多药株35株,敏感野生株11株。35株耐多药株和11株敏感野生株及标准株全部分别扩增出564 bp和604 bp长度的片段,分别是acrR和marOR基因的扩增产物,未发现acrR和marOR基因缺失株(图 1,图 2)。
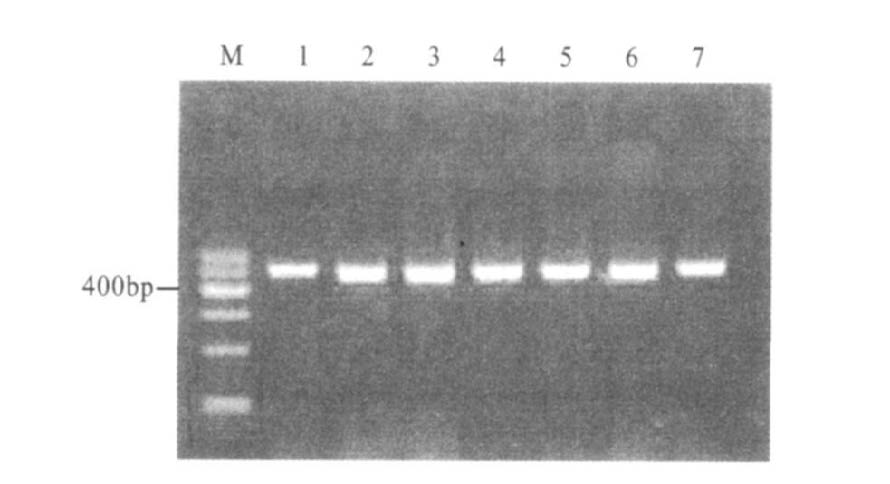
|
注:M:DNA Maker I;1:S51250;2:Z4;3:Z7;4:Z8;5:H6;6:H9;7:H12。 图 1 acrR基因PCR扩增结果(484bp) |
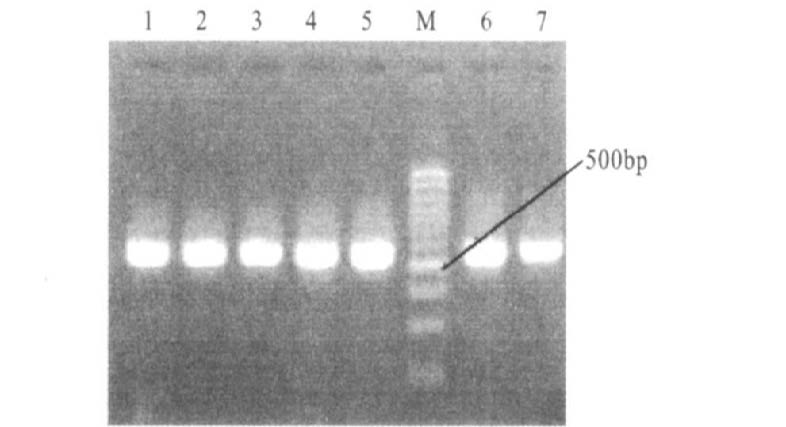
|
注:M:100bp DNA Ladder;1:S51250;2:Z4;3:Z7;4:Z8;5:H6;6:H9;7:H12。 图 2 marOR基因PCR扩增结果(604bp) |
2.3 PCR产物酶切鉴定
限制性内切酶TaqI可将acrR扩增产物消化成156和327 bp,将marOR扩增产物消化成340和264 bp(图 3,图 4)。
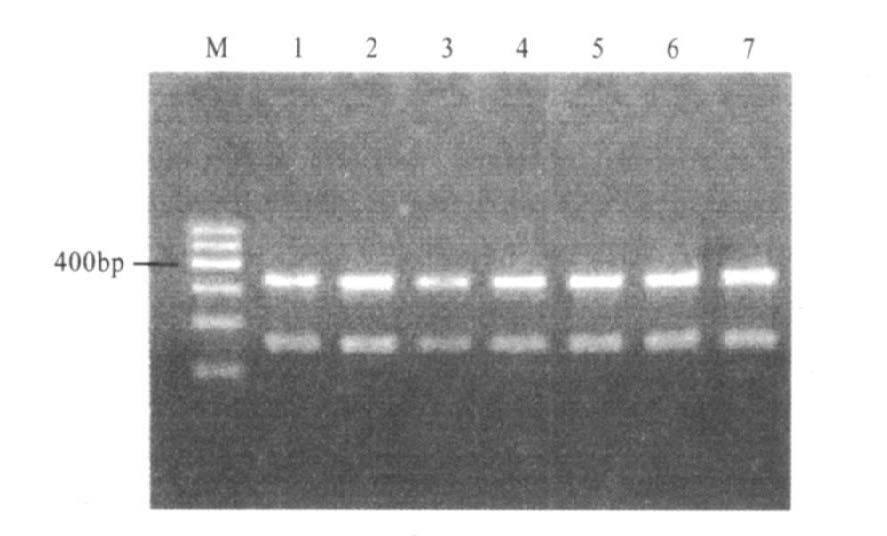
|
注:M:DNA Maker I;1:S51250;2:Z4;3:Z7;4:Z8;5:H6;6:H9;7:H12。 图 3 acrR基因TaqI酶切结果(156和327bp)(略) |
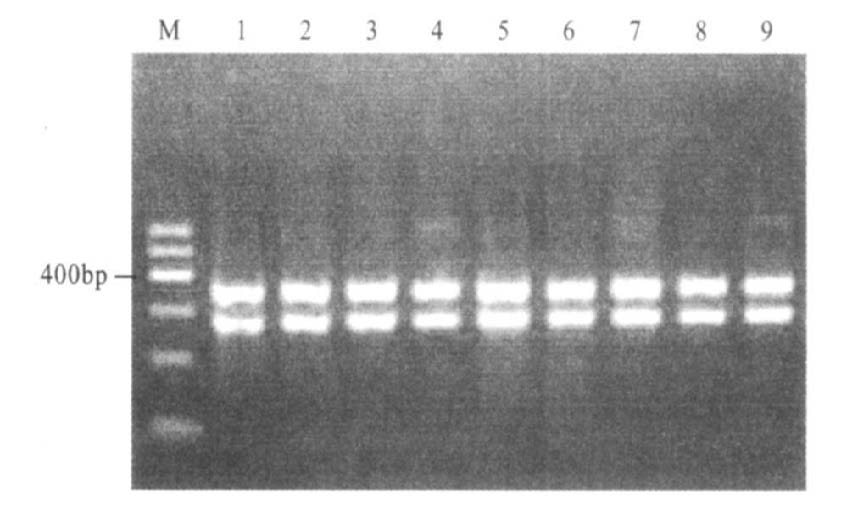
|
注:M:DNA Maker I;1:S51250;2:Z4;3:Z7;4:Z8;5:H6;6:H9;7:H12;8:N1;9:N11。 图 4 marOR基因TaqI酶切结果(264和340bp) |
2.4 耐多药调节基因acrR和marOR基因多态性分析
(1) acrR基因:11株敏感株及32株耐多药株具有一致的单链构象,有3株耐多药株具有不同的单链构象,敏感株突变率为0,耐多药株为8.57%,acrR基因总突变率为6.52%。(2)marOR基因:11株敏感株与30株耐多药株具有一致的单链构象,有5株耐多药株marOR基因存在突变,具有不同的单链构象,敏感株突变率为0,耐多药株突变率为14.29%,marOR基因总突变率为10.87%。
3 讨论本文结果显示,志贺菌对四环素、氯霉素、氨苄青霉素、环丙沙星及诺氟沙星等5种药物的耐药性相当严重,62.5%的菌株对3种或3种以上抗生素敏感性降低或耐药,与Wilson等[5]报道相一致。
新近研究已证实,志贺菌属细菌中存在AcrAB-TolC多重药物外排泵,该泵属于质子依赖型,能够同时产生针对有机溶剂、染料、去污剂以及多种抗生素的高水平耐多药[4]。acrAB的表达受多种调节因子的调节,最主要的为AcrR抑制子与mar操纵子。鉴于2个基因型别在acrAB-tolC表达的调节中的重要作用,本文参照大肠埃希菌acrR、marOR基因序列设计引物,证实类似大肠埃希菌的主动外排系统acrAB-tolC的调控基因acrR、marOR广泛分布于志贺菌中,志贺菌中可能存在类似大肠埃希菌的主动外排系统调控机制。
AcrR通常以二聚体形式结合于acrA基因和acrB基因启动子附近的位点,抑制acrA和acrB基因的转录,防止其过量表达,acrR突变导致编码AcrR蛋白的能力下降,从而对acrAB转录的抑制作用减弱,致使acrAB转录增加,AcrAB水平提高,外排泵表现活跃[6]。本研究发现,3株志贺菌耐多药株acrR基因与敏感株及标准株acrR基因的单链构象不同,发生突变,突变率为6.52%。与Olliver等[7]的研究结果一致,提示acrR突变与耐多药有关,但本研究也显示一些耐多药株未发现acrR突变,可能是由于其靶基因突变或膜耐药机制加强所致。
迄今已发现多种类型的marOR突变,突变可以是单个或多个碱基的颠换、缺失等。Margret Oethinger[8] 等研究发现,marOR基因第1481~1485位碱基缺失,致marA表达过度,引起对环丙沙星的高度耐药,Yoon-Hee Park[9]等对28株氟喹诺酮耐药大肠杆菌研究发现有18株(占64%)maoR基因存在点突变。本研究发现,5株志贺菌耐多药株marOR基因存在突变,突变率为10.87%。发生突变的5株志贺菌均为对四环素、氯霉素、氨苄青霉素、环丙沙星、诺氟沙星高度耐药的耐多药株,提示marOR基因突变可能对志贺菌耐多药起一定作用。我们将进一步研究志贺菌marOR基因的具体突变位点,为最终阐述志贺菌耐多药主动流出机制提供基础依据。
| [1] | Van Bambeke F, Balzi E, T ulkens PM. Ant ibiot ic eff lux pumps[J]. Bioch em Pharmacol, 2000, 60(4) : 457–470. DOI:10.1016/S0006-2952(00)00291-4 |
| [2] | Sulavik M C, Housew eart C, Cramer C, et al. Antibiotic suscept ibili?? ty prof iles of Escherichia col i st rains lacking mult idrug eff lux pump genes[J]. Ant imicrob Agents Chemother, 2001, 45(4) : 1126–1136. DOI:10.1128/AAC.45.4.1126-1136.2001 |
| [3] | Giraud E, Cloeckaert A, Kerboeuf D, et al. Evidence for act ive ef?? flux as the primary mechan ism of resist ance to ciprofloxacin in Salmonella ent eric aserovar Typhimurium[J]. Ant imicrob Agent s Chemother, 2000, 44(5) : 1223–1228. DOI:10.1128/AAC.44.5.1223-1228.2000 |
| [4] | 杨海燕, 段广才, 郗园林, 等. 主动外排系统acrAB 在志贺菌中分 布和表达[J]. 中国公共卫生, 2005, 21(6) : 685–687. |
| [5] | Wilson G, Easow JM, Mukhopadhvav C, et al. Isolat ion an d ant imi crobial suscept ibilit y of S higella f rom pat ient s with acut e gast roen teritis in Western Nepal[J]. J Med Res, 2006, 123(2) : 145–150. |
| [6] | Grkovic S, Brow n MH, S kurray RA. Transcript ional regulat ion of mult idrug ef flux pumps in bacteria[J]. Semin C ell Dev Biol, 2001, 12(3) : 225–237. DOI:10.1006/scdb.2000.0248 |
| [7] | Olliver A, Valle M, C haslus-Dancla E. Role of an acrR mutation in mult idrug resistance of in vit ro-select ed f luoroquinolone-resistant mut ant s of Salmonella enterica serovar T yphimurium[J]. FEMS Microbiol Let t, 2004, 238(1) : 267–272. |
| [8] | Margret Oethinger, Winfried V Kern, Angelika S, et al. Ineff ect ive?? ness of t opoisomerase mut at ions in mediat ing clinically significant fluoroquinolone resist ance in Escherichia coli in the absence of th e AcrAB Eff lux Pump[J]. Ant imicrob Agent s Chemother, 2000, 44(1) : 10–13. DOI:10.1128/AAC.44.1.10-13.2000 |
| [9] | Yoon-Hee Park, Jin-H ong Yoo, Dong-Ho Huh, et al. Molecur lar analysis of fluoroquinolone-resist ance in Escherichia coli on th e aspect of gyrase an d mult ipl e ant ibiot ic resistan ce(mar)gene[J]. Yonsei Medical Journal, 1998, 39(6) : 534–540. DOI:10.3349/ymj.1998.39.6.534 |
 2008, Vol. 24
2008, Vol. 24

 , 宋春花, 郗园林
, 宋春花, 郗园林