2. 大连市结核病医院
2. Department of Biochemistry and Molecular Biology, Dalian Medical University Dalian China, 116027
结核分枝杆菌是引起结核病(TB)的病原体。近年来,由于多耐药(MDR)结核分枝杆菌突变株的出现,使得结核病成为当今世界三大传染病之一。结核分枝杆菌能够在机体免疫系统功能正常的情况下生存于感染宿主的巨噬细胞内,不但未被消灭,反而受其保护,其关键在于分枝杆菌具有独特的细胞壁结构。乙胺丁醇(EMB)、异烟肼(INH)、利福平(RIF)是常见的抗结核药物,目前,对这3种药物作用机制的研究也各不相同[1-4]。迄今为止,这3种药物作用的直接靶点尚不清楚。本文采用与结核分枝杆菌有相同细胞壁结构,但生长快速且无致病性的耻垢分枝杆菌mc2155菌株作为模型,应用双向电泳技术[5]观察经不同浓度乙胺丁醇、异烟肼、利福平处理后,耻垢分枝杆菌生长变化情况,并提取最佳处理时间和浓度条件下的耻垢分枝杆菌细胞总蛋白,应用比较蛋白质组学技术,观察3种抗生素处理后耻垢分枝杆菌mc2 155细胞蛋白表达谱变化,探讨3种抗生素抑制分枝杆菌生长的作用机制,寻找直接作用靶标,为新型抗结核病药物的研究开发奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种及试剂耻垢分枝杆菌(M.smegmatis)mc2 155菌株(美国科罗拉多州立大学微生物系分枝杆菌研究室惠赠);乙胺丁醇(美国Sigma公司);异烟肼、利福平(上海信谊制药厂)。脂质双层(LB)培养基(美国Invitrogen/GIBCO公司);载体两性电解质、尿素、硝酸银、丙烯酰胺、甲叉双丙烯酰胺(Bis)(美国Sigma公司);三羟甲基氨基甲烷(Tris),十二烷荃磺酸钠(SDS),甘氨酸(glycine)(北京华美公司);低相对分子质量标准蛋白质(北京天为时代公司);其他试剂均为国产分析纯试剂。
1.1.2 仪器圆盘电泳槽、MVII型垂直板电泳槽(大连竞迈生物科技有限公司);高压电泳仪(北京君意东方电泳设备有限公司);高速台式离心机(上海安亭科学仪器厂);微量进样器(法国Gilson公司);GL20A全自动高速冷冻离心机(湖南仪器仪表厂离心机厂);pH计(意大利HANNA公司);THZ-92B台式恒温振荡器(上海跃进医疗器械厂);AEG-120电子分析天平(日本岛津公司)。
1.2 方法 1.2.1 菌株培养及生长曲线将耻垢分枝杆菌20l接种到2mlLB液体培养基中,37℃振荡培养,每4h于600nm处测定细菌培养液的吸光度(A)值,待A值达到0.7时,在各组培养基中分别加入终浓度为1.5,3.0,6.0,12.0和24.0g/ml的乙胺丁醇;0.02,0.04,0.08,0.16和0.32g/ml的异烟肼以及0.2,0.4,0.8,1.6和3.2g/ml的利福平;每3h于600nm处测定对照组、乙胺丁醇组,异烟肼组和利福平组细菌培养液A值,绘制生长曲线。
1.2.2 细菌总蛋白制备将耻垢分枝杆菌20l接种到2ml LB液体培养基中,37℃振荡培养,取对数生长期细胞备用。在各组培养基中分别加入终浓度为24.0g/ml的乙胺丁醇,0.08g/ml的异烟肼和0.8g/ml的利福平,继续培养3h后收获细菌。50mmol/L的Tris-HCl(pH6.8)缓冲液洗涤沉淀细菌,5000r/min,4℃离心15min×3,1ml的50mmol/L的Tris-HCl(pH6.8)缓冲液重新悬浮沉淀于微型离心管中,超声破碎裂解细菌,工作30s,间歇10s,重复20次,4℃ 8000r/min离心15min,上清液即为细菌总蛋白。分别在对照组、乙胺丁醇组、异烟肼组及利福平取少量上清液,用Bradford法[5]测定总蛋白质浓度,其余样品冻存于-20℃备用。分别提取空白对照组和3个抗生素组耻垢分枝杆菌mc2155细胞的总蛋白进行蛋白质组比较。
1.2.3 双向电泳蛋白质样品处理及电泳主要按照文献[5]进行。取15g细菌蛋白样品与等体积的2×样品缓冲液混合,室温放置1h。将0.6g尿素,540l双蒸水,200l溶液30%丙烯酰胺溶液,pH4~6载体两性电解质24l,pH 3~10载体两性电解质溶液4.8l,轻缓混匀后依次加入5l的10%过硫酸胺和4l四甲基乙二胺(TEMED),轻轻混匀,快速吸取90l上述混合液,从玻璃管(直径1mm,长8cm)的一端缓慢均匀灌入,避免产生气泡,室温聚合。组装好圆盘电泳槽,用微量进样器取准备好的样品液,缓慢从玻璃管的上端注入,使样品沉于胶面上,确定上槽与玻璃管之间无渗漏,倒入电泳缓冲液(阴极电泳缓冲液:20mmol/L氢氧化钠150ml。阳极电泳缓冲液:10mmol/L磷酸200ml)。接通电源,室温下1000V恒压电泳3h,进行等电聚焦。再将胶条从玻璃管中均匀挤出,在平衡缓冲液(5%2-巯基乙醇,62.5mmol/L Tris-HCl(pH6.8),2.3%SDS,10%甘油)中平衡30min,转移至15%分离胶上端,30mA恒流,进行十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳。电泳所得到的凝胶按文献[5]方法进行高灵敏度的银氨染色,在可见光灯箱下观察。
1.2.4 凝胶图像分析通过Canon5.0数码相机获取凝胶图像,利用PDQuest7.3.1软件完成对照组、乙胺丁醇组、异烟肼组及利福平组全蛋白凝胶图像之间的消减、斑点检测、匹配、量化、获取斑点位置坐标等分析,分别获得乙胺丁醇、异烟肼及利福平所致的蛋白质差异变化表达,并将这些蛋白质点在双向电泳图谱上标出。
2 结果 2.1 3种不同浓度抗生素对耻垢分枝杆菌mc2155增殖的影响结果显示,不同浓度的乙胺丁醇、异烟肼和利福平对耻垢分枝杆菌mc2155细胞的增殖均有不同程度的抑制作用。处理3h时,耻垢分枝杆菌mc2155细胞增殖开始受到明显的抑制;3种抗生素的最佳处理浓度分别为24.0g/ml乙胺丁醇,0.08g/ml异烟肼,0.8g/ml利福平;最佳处理浓度抑制耻垢分枝杆菌mc2155细胞增殖的作用,依次为利福平(50.59%)>异烟肼(39.21%)>乙胺丁醇(26.43%)。
2.2 抗生素处理前后mc2155细胞蛋白质表达图谱(图 1)
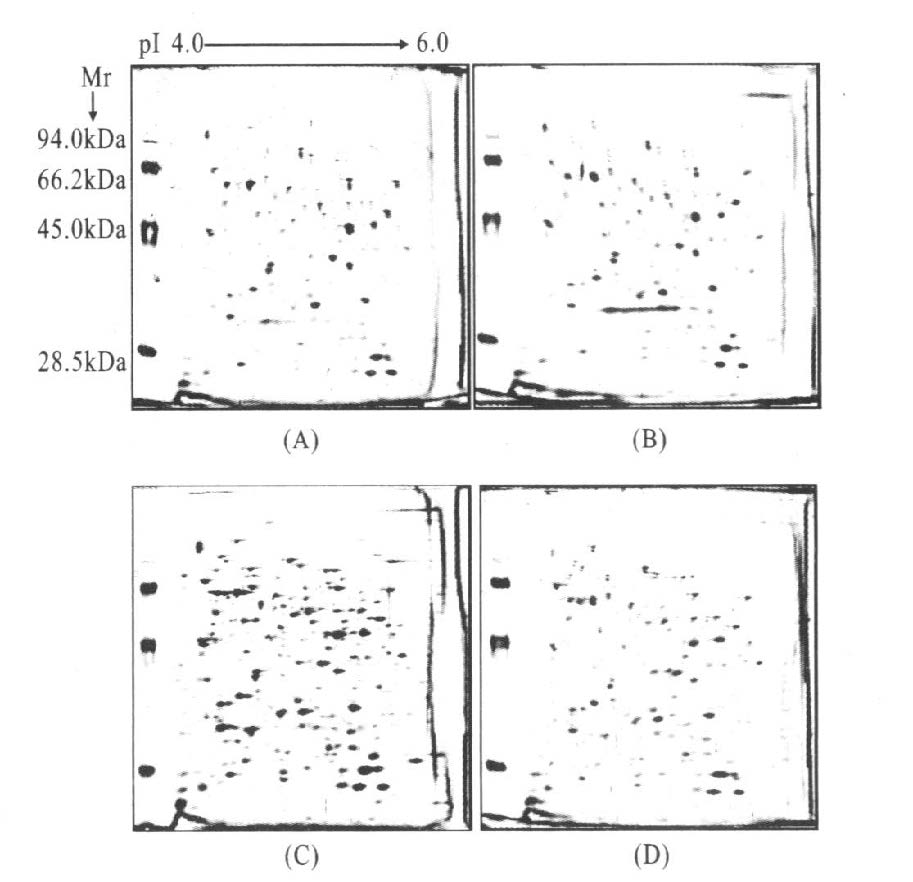
|
图 1 3种抗生素处理后耻垢分枝杆菌mc2155细胞蛋白双向电泳图谱 |
2.3 抗生素处理前后mc2155细胞蛋白质斑点相对分子质量分布(图 2)
图 2可见,用24.0g/ml乙胺丁醇,0.08g/ml异烟肼,0.8g/ml利福平分别处理耻垢分枝杆菌mc2155细胞3h后,各组蛋白的蛋白质斑点主要以低分子量蛋白为主,且相对分子量分布基本一致,各组蛋白质斑点数最多区域均在60kDa~90kDa之间,分别为对照组48.4%,乙胺丁醇处理组37.7%,异烟肼处理组38.0%和利福平处理组38.5%。
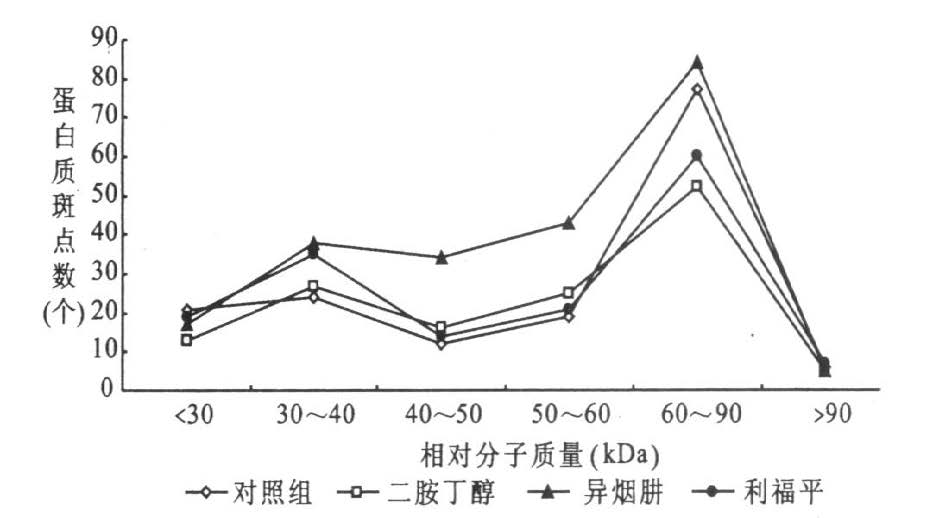
|
图 2 3种抗生素处理前后耻垢分枝杆菌mc2155细胞蛋白质斑点相对分子质量分布 |
2.4 抗生素处理前后mc2155细胞蛋白质斑点等电点分布(图 3)
图 3显示,对照组蛋白斑点在pH4.0~6.0范围内分布比较均匀。当pH分别介于4.0~5.0和5.5~6.0时,乙胺丁醇处理组蛋白斑点数少于对照组、异烟肼处理组和利福平处理组。异烟肼处理组蛋白斑点数在pH4.5~6.0之间多于对照组,乙胺丁醇处理组和利福平处理组蛋白,在pH4.0~4.5之间多于乙胺丁醇处理组而少于对照组和利福平处理组。当pH分别介于4.0~4.5和5.0~5.5时,利福平处理组蛋白斑点数与对照组蛋白相差不大,在pH4.5~5.0之间,利福平处理组蛋白斑点数与乙胺丁醇处理组蛋白相差不大但却明显少于对照组和异烟肼处理组。
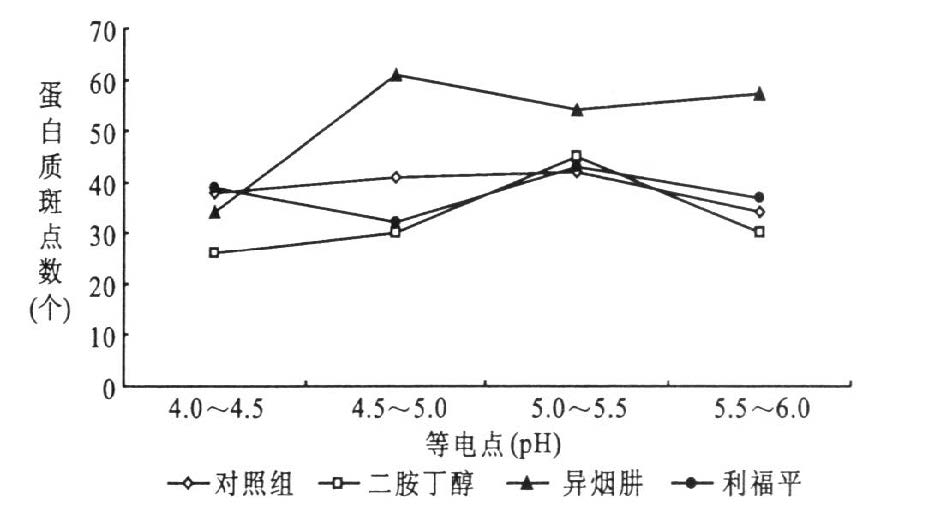
|
图 3 抗生素处理前后耻垢分枝杆菌mc2155细胞蛋白质斑点等电点分布 |
3 讨论
应用蛋白质组学方法从蛋白水平探讨乙胺丁醇、异烟肼和利福平的抗结核作用机制,首先要选择合适的药物作用时间及药物浓度,只有在这一时期和条件下对药物处理前后分枝杆菌的蛋白质组进行比较研究,才能比较准确和全面的找到与药物作用直接相关的蛋白质分子靶标,进而揭示药物作用的机制。本文结果表明,3种抗生素处理耻垢分枝杆菌细胞的最佳时间为3h,最佳处理浓度分别为24.0g/ml乙胺丁醇,0.08g/ml异烟肼和0.8g/ml利福平。选择这一条件下耻垢分枝杆菌细胞总蛋白质进行蛋白质组比较,可获得较为理想的结果。一方面由于药物处理3h时,耻垢分枝杆菌增殖第一次受到了明显的抑制作用,推测此时分枝杆菌增殖水平的降低是由药物作用而直接导致的,另一方面,在最佳药物处理时间点上选择抑制率最高的药物浓度,有利于比较这一时期的分枝杆菌的蛋白质组,便于发现并分别找出乙胺丁醇,异烟肼和利福平作用的直接靶标。
蛋白质双向电泳技术是当前蛋白质组研究中应用最广泛且具有良好灵敏度的蛋白质分离技术,应用双向电泳技术进行乙胺丁醇、异烟肼和利福平处理前后分枝杆菌蛋白组间的差异比较,可获得比其他蛋白质分离技术更全面的信息。本实验在进行等电聚焦预实验时,曾选用pH3.5~10.0的胶条,其分离效果较差,并发现耻垢分枝杆菌细胞蛋白主要分布在pH4.0~6.0范围内,与乐军等人的结果相一致[6]。本次试验结果显示,乙胺丁醇组、异烟肼组和利福平组的耻垢分枝杆菌细胞总蛋白质组之间及其与对照组的差异均有统计学意义,提示乙胺丁醇、异烟肼和利福平等3种抗生素的作用靶标确实各不相同,进一步研究可以通过对乙胺丁醇组,异烟肼组和利福平组中有特异性差异蛋白斑点的质谱测序,鉴定乙胺丁醇、异烟肼和利福平作用的直接靶标,从而为进一步揭示乙胺丁醇、异烟肼和利福平的抗结核机制提供试验依据,并可为新型抗结核药物的开发提供新的线索。
| [1] | Aimee E, Belanger, Juila, Inamine M. Molecular genetics of mycobacteria[M].Wshington D C: J r ASM Press, 2000: 191-199. |
| [2] | Yi Xin, Yinguo Huang, Michael McNeil. The presence of an en2 dogenous endo-D-arabinase in Mycobacterium smegmatis and characterization of its oligoarabinoside product[J]. Biochim Biophys Acta, 1999, 27 : 1473. |
| [3] | Broussy S, Coppel Y, Nguyen M, et al. 1H and 13C NMR charac2 terization of hemiamidal isoniazid-NAD(H)adducts as possible isoniazidibitors of isoniazid A reductase of Mycobacterium tubercu2 losis[J]. Chemistry, 2003, 9 : 2034. DOI:10.1002/chem.200204637 |
| [4] | 曾正国, 王南华. 现代实用结核病学[M]. 北京: 科学技术文献出 版社, 2003: 229. |
| [5] | 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2000: 124. |
| [6] | 乐军, 刘丽蓉, 谢建平, 等. 异烟肼耐药和敏感结核分枝杆菌的比 较蛋白质组学研究[J]. 中华微生物学和免疫学杂志, 2004, 24(4) : 258–262. |
 2008, Vol. 24
2008, Vol. 24

