2. 中国检验检疫科学研究院
氢醌(HQ)又名对二苯酚,是一种用途广泛的化学物质,长期接触可引起肝、肾及造血系统的损害[1, 2]。也有报道,长期皮肤暴露可引起多种皮肤损害,甚至引起氢醌职业性药疹样皮炎,出现严重的表皮松懈坏死[3, 4]。虽然有关氢醌引起皮肤损伤的报道较多,但是有关氢醌对皮肤细胞毒性作用的机制尚不清楚,这严重制约了氢醌职业性皮肤损伤的防治。为此我们建立了体外试验模型,体外培养SD大鼠表皮角质形成细胞,研究不同浓度氢醌对其细胞活力、乳酸脱氢酶(LDH)释放率及脂质过氧化的影响,以探讨氢醌对体外培养鼠角质形成细胞的毒性作用。
1 材料与方法 1.1 主要试剂与仪器无血清角质形成细胞培养基(K-SFM)(美国Gibco公司);氢醌(HQ)、四甲基偶氮噻唑蓝(MTT)及2′,7′-二氯乙酰乙酸盐荧光素(DCHF-DA)(美国Sigma公司);丙二醛(MDA)、还原型谷胱甘肽过氧化物酶(GSH-Px)及超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所);CO2培养箱、酶标仪、紫外分光光度计、流式细胞仪等。
1.2 角质形成细胞的培养参照文献[5]方法,取出生24 h以内SD大鼠的表皮,用0.25%中性蛋白酶-Ⅱ中和0.25%胰蛋白酶两步冷温消化法获取细胞,用K-SFM于6% CO2、37℃条件下培养,36 h后首次换液,以后每2~3 d换1次液,当细胞长至70%~80%时传代。
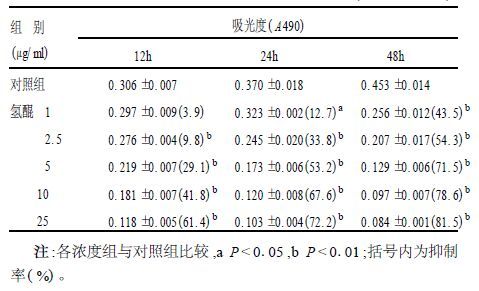
1.3 细胞毒性检测常规消化80%融合的单层培养细胞,按每孔5×104个细胞接种于96孔培养板。培养22 h后,向96孔板中分别加入设定浓度的氢醌,以不加药物的培养物为试验对照组。分别检测12,24和48 h的细胞存活力;终止作用前各孔加20 μl MTT(5 mg/ml),继续培养4 h,弃上清,加150 μl二甲基亚砜(DMSO)溶解,10 min后在酶标仪上于490 nm处检测,计算氢醌对角质形成细胞的抑制率。抑制率=1-试验组吸光度/对照组吸光度×100%。
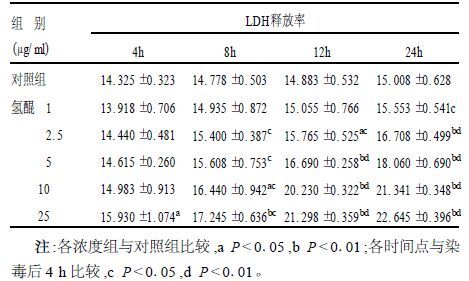
1.4 LDH释放测定通过LDH释放试验,检测氢醌对角质形成细胞膜损伤导致的细胞毒性:角质形成细胞以5×104个/孔的密度接种于96孔培养板,待80%细胞融合后用含0,1,2.5,5,10,25 μg/ml的氢醌进行染毒,分别在4,8,12,24 h后收集细胞,按照试剂盒提供的说明书进行测定。细胞毒性用LDH释放率表示:LDH释放率(%)=[LDH上清/(LDH上清+LDH细胞)]×100%。
1.5 细胞内活性氧(ROS)水平的测定角质形成细胞以5×104个/孔的密度接种于96孔培养板,待80%细胞融合后用含0,1,2.5,5,10,25 μg/ml的氢醌进行染毒,分别在4,8,12,24 h后收集细胞,用预冷的磷酸盐缓冲液(PBS)洗2遍,孵育于含20 μmol/LDCHF-DA的无血清培养基中,30 mim后,用流式细胞仪(激发光488 nm,发射光530 nm),测定荧光强度,计数1×105个细胞。
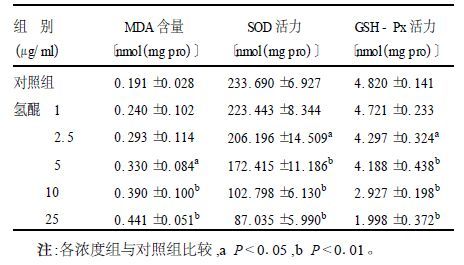
1.6 细胞中MDA含量、GSH-Px和SOD活力测定不同浓度氢醌处理角质形成细胞,12 h后收集、裂解细胞,蛋白质浓度(BCA)法测定蛋白浓度;分别用硫代巴妥酸法(TBA)、二硫代二硝基苯甲酸比色法和黄嘌呤氧化酶法测定MDA含量、GSH-Px和SOD活力[6],按试剂盒说明书操作。所有试验均做4组重复。
1.7 统计分析用OriginPro 7.5软件录入数据并绘图,采用SPSS 3.0软件进行统计学分析。
2 结果 2.1 氢醌对角质形成细胞的毒性检测结果(表 1)由表 1可见,氢醌对体外培养的表皮角质形成细胞有显著的抑制作用,并且随着药物浓度的加大,作用时间延长,氢醌对角质形成细胞增殖的抑制作用也显著增强。
| 表 1 氢醌对角质形成细胞增殖的抑制的作用(x ± s, n=4) |
2.2 氢醌对角质形成细胞LDH释放率的影响(表 2)
表 2显示,角质形成细胞经氢醌作用后,LDH的释放率呈明显的时间-剂量-反应关系。各浓度组与对照组比较,LDH释放率明显增加的最低浓度为2.5 μg/ml(染毒12 h后,P<0.05) ,最早时间为染毒后4 h(浓度为25 μg/ml时,P<0.05) 。
| 表 2 氢醌染毒后角质形成细胞不同时间LDH释放率(x ± s, n=4) |
2.3 氢醌对角质形成细胞活性氧水平的影响
不同浓度氢醌处理细胞不超过8 h,1 μg/ml与2.5 μg/ml浓度组与对照组相比较角质形成细胞的活性氧水平升高趋势不显著,差异均无统计学意义(P>0.05) ;5 μg/ml浓度组角质形成细胞的活性氧水平明显高于对照组,差异有统计学意义(P<0.05) ;氢醌浓度高于10 μg/ml,作用时间超过12 h,细胞内活性氧水平与对照组比较均显著的升高趋势,且差异有统计学意义(P<0.01) 。由此可见,氢醌对角质形成细胞活性氧水平的影响同样存在浓度-时间-效应关系。
2.4 氢醌对角质形成细胞MDA含量、SOD及GSH-Px活力的影响(表 3)表 3结果显示,不同浓度氢醌处理角质形成细胞12 h后,可引起MDA含量呈浓度依赖性增加;SOD与GSH-Px活力则相反,呈浓度依赖性抑制。各浓度组与对照组比较,使MDA含量显著性增加的最低浓度为5 μg/ml(P<0.05) ,使SOD与GSH-Px活力显著性降低的最低浓度为2.5 μg/ml(P<0.05) 。
| 表 3 氢醌染毒12h对角质形成细胞MDA含量、SOD及GSH-Px活力影响(x ± s, n=4) |
3 讨论
本试验发现,氢醌可通过引起细胞膜结构的改变而影响其完整性,从而导致细胞活力下降。MTT试验表明,氢醌对体外培养的角质形成细胞增殖有显著的抑制作用,在一定条件下呈明显的剂量-时间-效应关系;细胞LDH的释放与细胞活力明显相关,可作为细胞膜损伤的有效提标。不同浓度氢醌处理角质形成细胞4,8,12,24 h后,LDH释放率显示明显的时-效、量-效关系,说明氢醌可引起细胞膜的损伤。试验发现,角质形成细胞ROS水平随氢醌浓度的升高,作用时间的延长而上升,存在时效与量效关系;同时,SOD与GSH-Px活力抑制剂量关系与MDA增加相一致,说明细胞内可能形成了较高的自由基并发生了脂质过氧化。试验结果显示,使SOD与GSH-Px活力产生明显抑制的氢醌浓度较使MDA含量显著上升的浓度低,由此推断SOD与GSH-Px活力抑制可能是氢醌对角质形成细胞毒性作用的前提,氢醌可能是通过改变细胞内的氧化应激导致MDA含量增加,导致细胞膜损伤,进而产生细胞毒性。
研究结果显示,氢醌可以引起体外培养角质形成细胞活力降低,诱发细胞膜脂质过氧化和氧化应激增加,导致细胞膜受损,产生细胞毒性作用,这不仅提供了氢醌皮肤毒性作用的基础资料,而且为氢醌引起的皮肤损伤防治提供了科学依据。
| [1] | Kooyers TJ, Westerhof W. Toxicology and health risks of hydroquinone in skin lightening formulations[J]. JEADV, 2006, 20 : 777–780. |
| [2] | Kooyers T, Westerhof W. Toxicological aspects and health risks associated with hydroquinone in skin bleaching formula[J]. Ned Tijdschr Geneeskd, 2004, 148 : 768–771. |
| [3] | Nordlund JJ, Grimes PE, Ortonne JP. The safety of hydroquinone[J]. JEADV, 2006, 20 : 781–787. |
| [4] | Ouyang AL, Zhou Y, Hua P, et al. Effects of trypsin on the rat keratinocyte separation and subculture[J]. Chinese J Biotechnol, 2002, 18(1) : 59–62. |
| [5] | Hkkinen L, Koivisto L, Larjava H. An improved method for culture of epidermal keratinocytes from newborn mouse skin[J]. Methods in Cell Science, 2002, 23 : 189–196. |
| [6] | 钟振伟, 胡利人. 低铅染毒对大鼠脂质过氧化作用的影响[J]. 中国公共卫生, 2003, 19(8) : 1000–1001. |
 2008, Vol. 24
2008, Vol. 24

 , 胡秀丽2, 韩博2, 金涌2
, 胡秀丽2, 韩博2, 金涌2