2. 安徽省淮南市新华医院妇产科
2. Department of Obstetrics and Gynecology, Medical College, Anhui University of Science and Technology, Huainan 232001, China
子宫内膜异位症(EMs,简称内异症),为子宫外子宫内膜样组织异常增生,通常与腹膜炎症有关。白细胞介素-8(interleukin-8,IL-8) 是由单核细胞、巨噬细胞及血管内皮细胞等产生的一种小分子多肽,对中性粒细胞有较强的趋化游走作用,参与白细胞和内皮细胞的粘附过程,并具有促进血管新生的作用。为了解IL-8在内异症发病机制中的作用,选择典型内异症患者,检测其腹腔液及子宫内膜中IL-8的表达水平。结果报道如下。
1 对象与方法 1.1 对象2005年6月~2006年7月,选取安徽理工大学医学院教学医院妇产科收治的经腹腔镜检查确诊的内异症患者40例为内异症组,同期因卵巢良性肿瘤行腹腔镜手术的非内异症患者28例为对照组。年龄为26~46岁,内异症患者平均年龄(33.7±8.7) 岁,对照组平均年龄(32.1±7.9) 岁,年龄差异无统计学意义。临床诊断参照修订后美国生殖协会子宫内膜异位症分期法(R-AFS)[1]。所选内异症患者标本中,I-II期腹腔液、内膜组织标本均为17例,Ⅲ-Ⅳ期为23例。受检者月经周期规律,术前3个月未行激素和抗炎治疗。根据末次月经及子宫内膜组织学检查结果,内异症患者处增殖期22例,分泌期18例;对照组增殖期17例,分泌期11例。
1.2 标本采集借助腹腔镜采集标本。以20ml无菌注射器在腹腔镜引导下通过吸管吸取腹腔液,置无菌肝素抗凝管,常规离心,取上清置-70℃保存。取术前异位子宫内膜,立即置含1%抗生素无菌Hanks平衡盐溶液备检或置-70℃保存。
1.3 腹腔液IL-8检测采用固相夹心酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)。以试剂盒标准稀释液按1:2稀释标准品,绘制标准曲线。取腹腔液上清,每次检测设空白及标准各2孔,做双孔检测。于450nm处读取样品吸光度值,每孔测定2次,取均值,根据样品(A)值从标准曲线确定样品中IL-8含量。
1.4 内膜组织IL-8mRNA检测以实时荧光定量PCR(Real-timePCR)检测IL-8 mRNA水平。取内膜基质细胞悬液,调整细胞数至(1~2) ×106个/ml。以Trizol试剂抽提内膜基质细胞总RNA,并逆转录为互补DNA(cDNA)置-86℃冰箱备检。采用SYBRGreenI荧光标记定量检测IL-8 mRNA水平,总反应体系为25μl,包括上下游引物各10mol/L,MgCl2 2.5mmol/L,Ex-Taq1U,20mmol/L三磷酸脱氧核苷(dNTPs),10×PCR缓冲液(500mmol/L KCl,100mmol/L三羟甲基氨基甲烷,20mg/ml明胶,pH8.3) ,5×SYBRTMGreenⅠ液。2μl标准品或模板cDNA,模板cDNA以1:4稀释。引物设计参照Hirata等[2]方法进行,3-磷酸甘油醛脱氢酶(GAPDH),引物序列为上游(5′→3′):GGTATCGTGGAAGGACTCATGAC,下游(5′→3′):ATGCCAGTGAGCTTCCCGTTCAGC;IL-8引物序列为上游(5′→3′):GCCAACACAGAAATTATTGT,下游(5′→3′):CTGATTCTTGGATACCACAG;扩增片段长度分别为188、150bp。PCR扩增反应参数如下:95℃预变性300s,然后95℃50s,55℃40s,72℃90s共35个循环,最后72℃延伸300s。
1.5 标准品和标准曲线的制备采用管家基因GAPDH的PCR产物为参照标准,每次检测对标准品行10倍梯度稀释,取5个梯度(106,105,104,103和102拷贝/(μl)作为扩增标准品绘制标准曲线。
1.6 统计分析以x±s表示IL-8蛋白水平;以趋化因子logcDNA/logGAPDH比值表示IL-8 mRNA表达水平,排除在RNA提取和逆转录过程中出现的变异。采用SPSS 11.5软件进行分析。
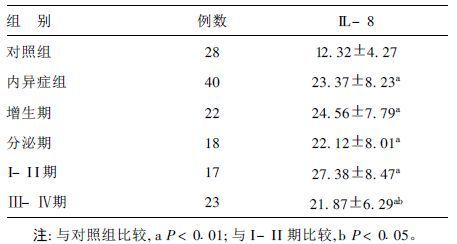
2 结果 2.1 内异症患者腹腔液IL-8的表达水平(表 1)内异症患者IL-8表达水平高于对照组,差异有统计学意义(P<0.01) ,其中增生期和分泌期表达水平分别为(24.56±7.79) ,(22.12±8.01) pg/ml,差异无统计学意义(P>0.05) 。I-II期、Ⅲ-Ⅳ期IL-8表达差异有统计学意义(P<0.05) ,且IL-8的表达与临床分期呈负相关。
| 表 1 各期内异症患者腹腔液IL-8表达水平(x±s,pg/ml)) |
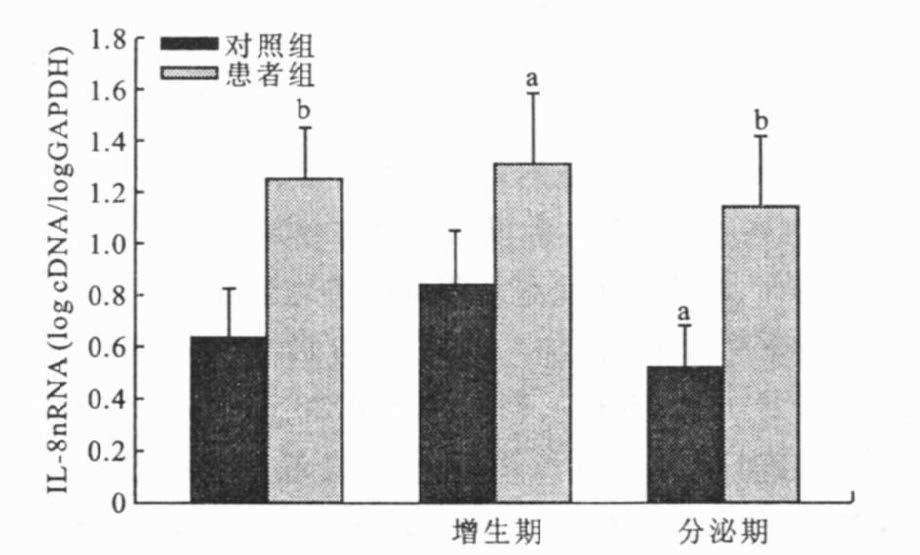
2.2 内膜组织IL-8 mRNA表达水平(图 1)
以IL-8 mRNA的logcDNA/logGAPDH比值的x±s表示IL-8 mRNA平均水平。对照组内膜组织增生期、分泌期IL-8 mRNA分别为0.8311±0.2028,0.5006±0.1531,差异有统计学意义(P<0.05) ;而内异症组2期的IL-8 mRNA分别为1.3011±0.2689,1.1239±0.2738,差异无统计学意义(P>0.05) ,但均高于对照组。
|
注:与增生期对照组比较,a P<0.05;与对照组比较,b P<0.01。 图 1 内膜组织IL-8的表达 |
3 讨论
本研究发现,内异症组腹腔液中IL-8表达明显高于对照组,与文献报道类似[3]。患者腹腔中IL-8可能主要来源于腹腔液中的巨噬细胞,巨噬细胞可产生IL-1,从而诱导子宫内膜间质细胞表达IL-8。此外内异症患者腹腔液中的巨噬细胞数量和活性增加,分泌更多的细胞因子,如肿瘤坏死因子-α(TNF-α)等[4],使腹腔液中的微环境发生改变,使经血逆流的内膜细胞更容易在异位内膜滋生。病程早期患者腹腔液中的IL-8浓度比晚期显著性升高,与Gazvani等报道一致[5],推测除IL-8参与疾病致病过程,可能存在其他趋化因子参与疾病的慢性化。IL-8为CXC家族其功能区含有谷氨酸-亮氨酸-精氨酸(ELR)基团,主要在疾病的急性反应期介导炎性细胞起作用,与其受体(CXCR1/2) 可同时表达于子宫内膜细胞[6],趋化及激活中性粒细胞释放一系列炎性细胞因子,调节血管生成因子的活性,促进内膜细胞与腹膜的粘附,加快异位种植灶的血管生成,增加异位灶在盆腔种植的可能性[7],从而以自分泌和旁分泌的形式刺激异位灶增殖。
本研究显示,对照组IL-8 mRNA的表达呈周期性改变,与文献报道一致[8]。IL-8 mRNA在子宫内膜中的周期性改变表明,类固醇激素可能直接和间接调节IL-8表达,IL-8在增生期高表达,中性粒细胞在行经前浸入子宫内膜,它们可能参与脱落的子宫内膜降解和消化,分泌晚期上调的IL-8可能调节中性粒细胞的募集。患者组增生期与分泌期腹腔液和内膜组织中IL-8 mRNA的水平差异无统计学意义,提示内异症患者中激素水平不是影响IL-8分泌的主要因素,可能因为患者机体免疫调节系统的改变影响IL-8表达,此时子宫内膜基质细胞对细胞因子、激素的刺激作用更敏感,反应能力更强,如雌激素、巨噬细胞分泌的生长因子有效刺激子宫内膜基质细胞IL-8的分泌和细胞黏附作用。
| [1] | Hill NC, El-Toukhy T, Chandakas S, et al. Safety of the helical thermal Coagulator in treatment of early stage endometriosis[J]. J Obstet Gynaecol, 2005, 25(1) : 52–54. DOI:10.1080/01443610400024906 |
| [2] | Hirata H, Arima M, Cheng G, et al. Production of TARC and MDC by naive T cells in asthmatic patients[J]. J Clin Immunol, 2003, 23(1) : 34–45. DOI:10.1023/A:1021948214742 |
| [3] | Gazvani R, Smith L, Fowler PA. Effect of interleukin-8 (IL-8),anti-IL-8,and IL-1on endometrial cell survival in combined endometrial gland and stromal cell cultures derived from women with and without endometriosis[J]. Fertil Steril, 2002, 77(1) : 62–67. DOI:10.1016/S0015-0282(01)02954-5 |
| [4] | Debrock S, De Strooper B, Vander Perre S, et al. Tumour necrosis factor-alpha,interleukin-6 and interleukin-8 do not promote adhesion of human endometrial epithelial cells to mesothelial cells in a quantitative in vitro model[J]. Hum Reprod, 2006, 21(3) : 605–609. |
| [5] | Gazvani MR, Christmas S, Quenby S, et al. Peritoneal fluid concentrations of interleukin-8 in women with endometriosis:relationship to stage of disease[J]. Hum Reprod, 1998, 13(7) : 1957–1961. DOI:10.1093/humrep/13.7.1957 |
| [6] | Charo IF, Ransohoff RM. The many roles of chemokines and chemokine receptors in inflammation[J]. N Engl J Med, 2006, 354(6) : 610–621. DOI:10.1056/NEJMra052723 |
| [7] | Lockwood CJ, Kumar P, Krikun G, et al. Effects of thrombin,hypoxia,and steroids on interleukin-8 expression in decidualized human endometrial stromal cells:implications for long-term progestin-only contraceptive-induced bleeding[J]. J Clin Endocrinol Metab, 2004, 89(3) : 1467–1475. DOI:10.1210/jc.2003-030141 |
| [8] | 孙琳, 万莉, 胡昌玲, 等. 外周血IL-8 mRNA表达与子宫内膜异位症相关性[J]. 中国现代医药杂志, 2006, 8(12) : 1–2. |
 2008, Vol. 24
2008, Vol. 24