2. 中国医科大学90期七年制;
3. 中国疾病预防控制中心营养与食品安全所
伏马菌素(fumonisin,FB)是近年来发现的一组镰刀菌产生的真菌毒素,其中FB1是污染玉米的主要成分,也是导致伏马菌素毒性作用的主要原因,广泛存在于世界范围的玉米及其制品中,对人类健康和畜牧业发展构成潜在威胁,成为真菌毒素中继黄曲霉毒素后的又一个研究热点[1]。国际癌症研究中心(IARC)把FB划分到2B组,即人类可能的致癌物[2, 3]。用于分析玉米和玉米制品中的FB的方法有数种,包括薄层色谱法(TLC)、酶联免疫吸附分析(ELISA)、高效液相色谱法(HPLC)等。HPLC方法具有灵敏度高、稳定性好的特点,一般定量检测玉米及玉米相关食品中的FB多采用此种方法[4]。为提高其检测的准确性,本研究利用邻苯二甲醛(OPA)柱前衍生高效液相色谱法检测玉米产品中FB1。现报告如下。
1 材料与方法 1.1 材料 1.1.1 仪器和试剂液相色谱系统(包括Waters510泵、Waters420荧光检测器,美国Waters公司);液相色谱柱(150×4.6mm,用5μm的ODS填装不锈钢C18反相柱);固相提取柱、真空多歧管固相萃取装置(美国Varian公司);普通离心机(上海医用分析仪器厂);超声波清洗器(上海超声波仪器厂);粉碎机(河北仪器厂);滤膜(孔径0.45μm);伏马菌素B1、2-巯基乙醇、邻苯二甲醛(美国Sigma公司);甲醇、乙腈(均为色谱纯,山东禹王实业有限公司);其他试剂均为分析纯。
1.1.2 样品样品采自沈阳市售玉米及玉米面。
1.2 方法 1.2.1 仪器条件流动相:甲醇-0.1mol/L NaH2PO4(77:23,V:V,PH3.3) ;流速:1ml/min;荧光检测器波长:激发波长333nm,发射波长425nm;进样量:10μl。
1.2.2 样品处理研磨玉米使其90%可以通过250~500μm网筛。称取25g样品加到塑料离心管中,加入50ml甲醇水溶液(3:1) ,振荡混合3min。混合液离心10min,用1mol/L的NaOH调pH值5.8~6.5之间,中性滤纸过滤。
装SPE柱,用5ml甲醇洗柱,再用5ml甲醇水(3:1) 过柱。精密量取10ml提取液,过SPE柱(速度≤2ml/min),然后依次用5ml甲醇水(3:1) 、3ml甲醇洗柱(避免SPE柱变干),再用1%冰醋酸甲醇溶液10ml洗脱毒素(速度≤1ml/min),用20ml大试管收集洗脱液。取4ml洗提液,在60℃用氮气吹干。用1ml甲醇溶解残留物并定容到4ml,再次在相同条件下吹干。干燥样品残留物可在4℃保存1周。
1.2.3 衍生化及HPLC分析用200μl甲醇溶解上述残留物。取20μl加到小试管中,加入180μl邻苯二甲醛(OPA)试剂,混合。在加入OPA试剂1min内吸取10μl注射到LC系统。所有的FB1峰应该是单个的。以样品提取液的峰与FB1标准品的峰保持时间进行比较、鉴定(出峰时间相同)。如果样品提取液的FB1峰超过FB1标准品的峰,需用甲醇再次稀释提取液并再次衍生。
1.2.4 标准曲线的制作准确吸取浓度为1mg/ml的FB1储备液,配制成0.1,0.2,0.5,1,2,5,10,20μg/ml浓度标准液,取20μl FB1标准品工作液到小试管中,加入180μl OPA试剂,漩涡震荡混合。10μl进样(在加入OPA试剂1min内),以FB1浓度对峰面积制作标准曲线。
2 结果 2.1 标准曲线以FB1标准液浓度为横坐标,色谱峰面积为纵坐标,制得标准曲线。回归方程为:Y=1.08e+6X(r=0.998,P<0.05) ,FB1的最低检出浓度为0.1μg/ml。
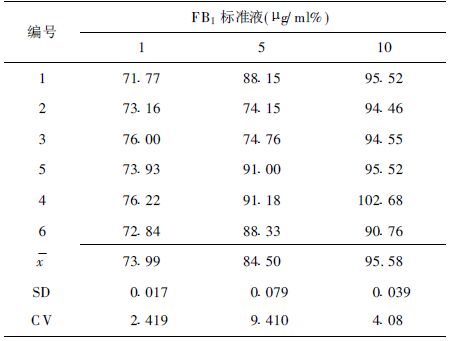
2.2 回收率(表 1)做1,5,10μg/ml 3个加标浓度的回收率测定实验。回收率在71.77%~102.68%之间,平均回收率为84.72%,总变异系数为12.17%。
| 表 1 3个加标浓度的回收率测定结果(%) |
2.3 准确度和精密度
准确度试验以回收率表示;精密度试验用1,5,10μg/ml 3个加标浓度的样品,每份样品3个平行样,在相同条件下连续6d重复测定,计算各浓度测定结果的变异系数,分别为6.02%,3.81%和4.32%。
2.4 样品测定用本方法检测24份沈阳市售玉米及玉米制品,阳性率为42.83%,阳性样品中FB1平均含量为(0.67±0.03) μg/g。
3 讨论FB是一组结构相似的双酯类化合物,属于极性分子,为白色粉末状,易溶于水、甲醇及乙腈一水中,适合采用反相HPLC法检测。由于它们缺少一个重要的紫外发光团,没有固有的荧光,因此,分析天然污染样品中FB的HPLC方法需要在样品提纯后进行衍生化。在近期的一个世界范围的玉米及玉米制品中FB的污染水平调查中,90%以上的实验室是使用柱前衍生的HPLC方法进行定量检测[4]。本文建立的采用OPA柱前衍生的HPLC方法检测沈阳市售玉米中FB1结果,与作者其他方法检测的结果一致[1],且快速、经济、灵敏度高、准确可靠。
| [1] | 宫慧芝, 计融, 杨军, 等. 伏马菌素B1免疫学检测方法的建立[J]. 中国公共卫生, 2006, 22(7) : 840. |
| [2] | Gelderblom WCA, Marasas WFO. Cancer promoting potential of different strains of Fusarium moniliforme in a short term cancer initiation promotion assay[J]. Carcinogenesis, 1988, 9 : 1405–1409. DOI:10.1093/carcin/9.8.1405 |
| [3] | Marasas WFO,Miller JD,Riley RT.Environmental Health Criteria 219:fumonisin B1,International Programme on Chemical Safty[R].Geneva:EHC,2000:150. |
| [4] | G.S.Shephard. Chromatographyic determination of the fumonisin mycocoxins[J]. Journal Chromat ography A, 1998, 815 : 31–39. DOI:10.1016/S0021-9673(98)00187-3 |
 2008, Vol. 24
2008, Vol. 24