单细胞凝胶电泳(SCGE)亦称彗星试验,是一种在单细胞水平检测有核细胞DNA断裂的荧光检测技术,具有快速、简便、灵敏、样本需要量少等特点,凡能制成单细胞悬液的真核细胞均可用此方法进行DNA损伤的研究。目前已广泛用于检测外源毒性物质、氧化、紫外线和电离辐射引起的DNA分子损伤[1]。体外实验发现,稀土元素可引起细胞DNA的损伤,具有一定的遗传毒性[2]。但长期稀土暴露能否引起DNA的损伤,目前尚不清楚。本文采用SCGE法观察长期喂饮稀土化合物氯化钇的大鼠外周血淋巴细胞DNA损伤情况,以期为明确稀土的遗传毒性提供数据。
1 材料与方法 1.1 样品稀土Y2O3(纯度99.99%)(珠江冶炼厂)。用盐酸溶解,调pH值4.5~6左右,定容后备用。
1.2 动物刚断乳健康纯系清洁级Wistar大鼠(70±5) g,(第一军医大学实验动物中心,动物证号:2003A072) 。喂养3d后,随机分为3组:对照组、低剂量组、高剂量组;每组10只,雌雄各半。分别饮用含稀土浓度为0,53.4,5340mg/L的饮用水,自由取食,饲养温度为22~28℃。同一剂量组内雌雄交配,生产后雌雄分开,子代饮水、饲养条件同亲代,喂养80周。
1.3 主要试剂与仪器三(羟甲基)氨基甲烷(Tris);Triton X-100(美国Genview公司);二甲基亚砜(DMSO,美国Sigma公司);大鼠淋巴细胞分离液(ρ=1.083,pH 7.0~0.5) (天津灏洋生物制品科技有限责任公司);低熔点琼脂糖(LMPA,美国Amresco公司);正常熔点琼脂(NMPA,西班牙Biowest公司);其他试剂均为国产分析纯。CH-BJ45-2光学显微镜(日本Olympus公司);AX200型倒置荧光显微镜(德国ZEISS公司)。
1.4 方法 1.4.1 淋巴细胞悬液制备将大鼠用乙醚麻醉后,从心脏取1ml血,与磷酸盐缓冲液(PBS)1:1混匀后,加入装有2ml的大鼠淋巴细胞分离液的离心管内,2000r/min离心15min,收集界面上的细胞,放入含PBS 4~5ml的试管中,充分混匀后,1500r/min离心10min,弃上清。将沉淀悬于PBS中,混匀离心,反复洗2次即得到所需细胞。将细胞悬于PBS溶液中,制成浓度为2×105个/ml细胞悬液4℃备用。
1.4.2 单细胞凝胶电泳按文献[3]进行。电泳后取出载玻片,用0.4mmol/L Tris(pH=7.5) 漂洗载玻片3次。用30μl SYBR Gold染色,荧光显微镜下观察摄取图像。每组选择100个细胞,用CASP彗星分析软件逐个细胞分析。
1.5 统计分析采用SPSS 10.0软件进行t检验。
2 结果 2.1 大鼠外周淋巴细胞的单细胞凝胶电泳在单细胞凝胶电泳中,DNA被SYBR Gold染色,未发生断裂的细胞只有一个圆形的荧光头部;发生DNA断裂的细胞则表现为断片向阳极方向迁移,形成一个像彗星样的拖尾。DNA损伤越严重,拖尾越长。对照组细胞呈圆形,边缘清晰;低剂量组细胞边缘有些模糊,表明DNA有一定的损伤;高剂量组细胞出现明显的拖尾现象。
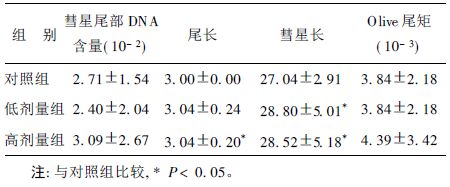
2.2 大鼠外周淋巴细胞DNA损伤(表 1)结果表明,与对照组比较,低剂量和高剂量淋巴细胞DNA形成的彗星尾部DNA含量、尾长、彗星长、Olive尾矩5个指标均高于对照组。其中,低剂量组的彗星长、高剂量的尾长和彗星长与对照组比较,差异有统计学意义(P<0.05) ,提示长期喂饮稀土可造成大鼠外周血淋巴细胞的DNA损伤。
| 表 1 不同剂量稀土对大鼠外周血淋巴细胞DNA的损伤(x ± s, n= 100) |
3 讨论
稀土是否有遗传毒性一直存在争议。杨辉等[2]提出,20~100μg/ml的氯化钇和氯化镨可引起体外培养的人外周血淋巴细胞DNA的损伤。屈艾[4]等发现,20~80mg/L氧化钬灌胃后小鼠骨髓细胞DNA的彗星头长、尾长、拖尾率和DNA损伤率明显高于对照组,且存在明显的剂量-效应关系。Jha[5]等认为,Pr6O11和Nd2O3能使小鼠骨髓染色体突变率明显增加。但也有文献[6]报道,用1~100mg/(kg·bw)的混合稀土硝酸盐连续5d给大鼠灌胃,未出现骨髓细胞染色体畸变率的增高;215~500μg/ml混合稀土硝酸盐及钇等8种单一稀土盐不能诱发体外培养的人外周血淋巴细胞染色体的畸变、姐妹染色单体互换以及非周期DNA合成的增高。造成这种差异的原因可能与稀土的摄入途径和剂量有关。本文结果显示,与对照组比较,低剂量组彗星长、高剂量组尾长和彗星长有显著增加(P<0.05) ,提示长期喂饮一定剂量的稀土可造成大鼠外周血淋巴细胞DNA的损伤,并可能影响机体的免疫功能[7, 8]。由于本实验中,低剂量组Y3+的浓度与现有稀土日允许摄入量标准相当,提示长期摄入现有稀土日允许摄入量标准的Y3+可能并不安全,稀土日允许摄入量标准值得进一步商榷。
| [1] | 杨维东, 罗琛, 田雪梅, 等. Ce(NO3)3对不同细胞DNA的损伤作用研究[J]. 中山大学学报, 1999, 38(5) : 50–53. |
| [2] | 杨辉, 嵇庆, 张锡然, 等. 氯化钇和氯化镨引起的人淋巴细胞DNA分子损伤的研究[J]. 遗传, 1998, 20(2) : 16–18. |
| [3] | 龚晓兵, 唐永煌, 张立伐, 等. 单细胞凝胶电泳技术检测慢性乙型肝炎患者外周血淋巴细胞DNA的损伤[J]. 广东医学, 2003, 24(1) : 21–22. |
| [4] | 屈艾, 汪承润, 薄军, 等. 运用单细胞凝胶电泳研究稀土元素钬对小鼠骨髓细胞DNA的损伤[J]. 癌变·畸变·突变, 2004, 16(6) : 328–331. |
| [5] | Jha AM, Singh AC. Clastogenicity of lanthanides:induction of chromosomal aberration in bonemarrow cells of mice in vivo[J]. Mutat Res, 1995, 341 : 193–1971. DOI:10.1016/0165-1218(95)90009-8 |
| [6] | 穆传杰, 段浑莲. 稀土化合物致突变性的研究[J]. 中国稀土学报:卫生毒理学专辑, 1985 : 48–53. |
| [7] | 董淑英, 应长青, 闻颖, 等. 醋酸铅对小鼠免疫细胞增殖和DNA损伤的研究[J]. 中华劳动职业病杂志, 2005, 23(6) : 457–458. |
| [8] | 郭来有, 赵玉兰. 稀土元素对作业工人细胞免疫功能的影响[J]. 中国公共卫生, 1998, 14(5) : 289–290. |
 2008, Vol. 24
2008, Vol. 24

 , 刘洁生
, 刘洁生