2. 中国环境科学研究院
五氯酚钠作为一种高效、低廉的广谱杀虫剂、防腐剂、除草剂曾长期在世界范围内使用。尽管目前欧洲一些发达国家己停止或限制使用五氯酚钠,但在一些发展中国家五氯酚钠仍被作为重要的农药而使用。其对人类健康的影响引起了普遍的关注[1-3]。有关五氯酚钠的致突变性研究各种观点不一[4, 5]。本文应用Ames试验、小鼠淋巴瘤细胞试验和体外染色体畸变试验研究五氯酚钠的致突变性。
1 材料与方法 1.1 试验材料 1.1.1 试验细胞株小鼠淋巴瘤细胞L5178Y(北京市疾病预防控制中心惠赠)。培养基用含10%马血清和双抗的RPMI 1640培养液,集落培养使用含20%马血清和双抗的RPMI 1640培养液。在5% CO2、37℃、饱和湿度下常规悬浮培养。中国仓鼠卵巢细胞(CHO)(中国医学科学院基础医学研究所基础医学细胞中心)。
1.1.2 菌株组氨酸缺陷型鼠伤寒沙门菌TA97、TA98、TA100和TA102菌株(美国加利福尼亚大学Ames试验室)。
1.1.3 试剂RPMI 1640培养基、胰酶、谷氨酰胺(美国Gibco公司);次黄嘌呤、甘氨酸、胸腺嘧啶核苷、三氟胸苷、丝裂霉素(美国Sigma公司)。使用经多氯联苯(PCBs)诱导的大鼠肝匀浆并加相应的辅助因子配制成的混合物作为体外代谢活化剂(S9 mix)。
1.1.4 受试物五氯酚钠(天津大沽化工厂);其中多氯代二苯并二英(PCDDs)和多氯代二苯并呋喃(PCDFs)的含量分别为15.76×10-6 g/g和2.26×10-6 g/g。
1.2 Ames试验按Maron和Ames等平板掺入法[6]。采用经鉴定生物学特性均符合要求的鼠伤寒沙门菌组氨酸缺陷型TA97、TA98、TA100和TA102 4株试验菌株,用多氯联苯(PCB)诱导的大鼠肝匀浆S9作为体外代谢活化系统。根据毒性测定结果,试验样品设500,1 000,2 000,5 000 μg/皿4个剂量组,同时设溶剂对照组和阳性对照组。每个剂量设3个平行平皿,重复试验2次。如果样品的回变菌落数达溶剂对照的2倍以上,并呈剂量-回变反应关系者,则定为阳性。
1.3 小鼠淋巴瘤细胞试验 1.3.1 清除系统中的自发回变用含3.0 μg/ml胸腺嘧啶、5.0 μg/ml次黄瞟呤、0.1 μg/ml氨甲蝶呤及7.5 μg/ml甘氨酸RPMI 1640培养液处理L5178Y细胞1 d,转移至不含氨甲蝶呤的上述培养液中继续培养2 d,以去除自发回变。
1.3.2 受试物染毒处理细胞取生长良好的细胞,调整细胞密度为5×105/ml,受试物设50,100,150 μg/ml 3个剂量,按1%加入受试物,低速振荡培养3 h。离心,弃上清液,用RPMU 1640培养液洗涤细胞2次,重新悬浮细胞于含10%马血清的RPMI 1640培养液中,并调整细胞密度为2×105/ml。
1.3.3 第0 d的平板接种效率(PE0) 测定取适量处理过的细胞悬液,梯度稀释至8个/ml,接种96孔板中,每个剂量用1块平板,置于5% CO2、37℃、饱和湿度下培养12~14 d,记数每块平板有集落生长的孔数。
1.3.4 实变基因表达按步骤1.3.2所得细胞悬液表达培养2 d,每天记数细胞数并保持密度在106/ml下,计算相对悬浮生长率。
1.3.5 第2d平板接种效率(PE2)测定 2 d表达培养结束后,取适量细胞悬液,按1.3.3方法进行梯度稀释,并接种96孔板中,每个剂量做1块平板,培养12~14 d,记数每块平板有集落生长的孔数。
1.3.6 三氟胸苷(TFT)抗性突变频率(MF)测定2d表达培养结束后,取适量细胞悬液,调整细胞密度为1×104/ml,加入TFT,终浓度为3 μg/ml,接种96孔板,每孔2 000个细胞,每个剂量做2块平板,阴性对照接种4块平板,置于5% CO2、37℃、饱和湿度下培养12~14 d,记数每块平板有集落生长的孔数。
1.3.7 计算平板接种效率和突变频率平板接种效率(PE)=-ln(空孔数/总孔数)/每孔细胞数;平板TFT抗性突变频率=-ln(空孔数/总孔数)/每孔细胞数/PE2。
1.3.8 结果判定受试物组的突变频率达到自发突变频率的2倍以上,并呈剂量-反应效应,则可判定为阳性。仅在某剂量组出现突变频率显著高于阴性对照但无剂量-反应关系,则为可疑阳性。
1.4 体外染色体畸变试验[7]试验在加和不加代谢活化系统条件下进行。根据预试验结果,受试物组的终浓度设定为40,80和160 μg/ml(-S9) ,及80,160和240 μg/ml,(+S9) 。非代谢活化组阳性对照为丝裂霉素C,剂量为0.85μg/ml。代谢活化组阳性对照为环磷酰胺,剂量为10 μg/ml。常规对细胞染毒,收获细胞,低渗处理,制片、阅片。结果评价:下列2种情况下可判定受试物在本试验系统中具有致突变性:(1) 受试物引起染色体结构畸变数的增加差异有统计学意义,并与剂量增加相关。(2) 受试物在任何一个剂量下,差异有统计学意义,并有可重复性的阳性反应。
1.5 统计分析采用SPSS 10.0软件进行χ2检验。
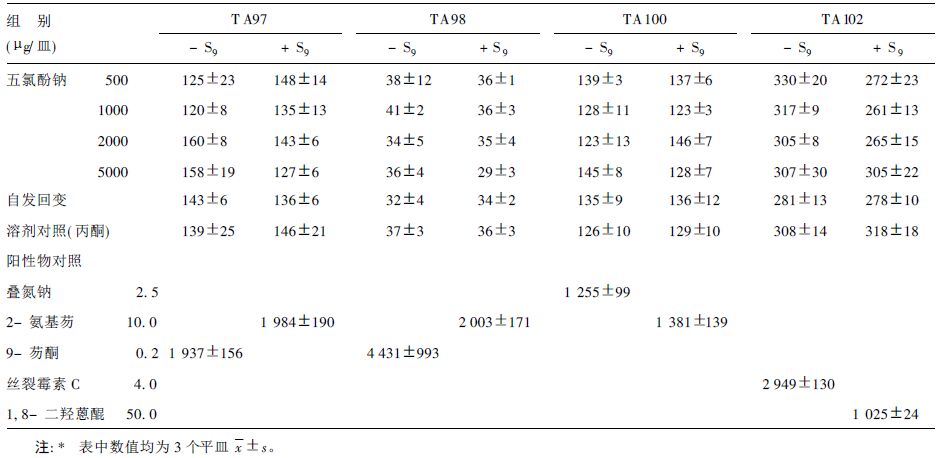
2 结果 2.1 五氯酚钠Ames实验结果(表 1)由表 1可见,五氯酚钠对鼠伤寒沙门菌TA97、TA98、TA100、TA102菌株无论直接作用和代谢活化后作用,均未呈现致突变性。
| 表 1 五氯酚钠对鼠伤寒沙门菌回变结果*(x ± s) |
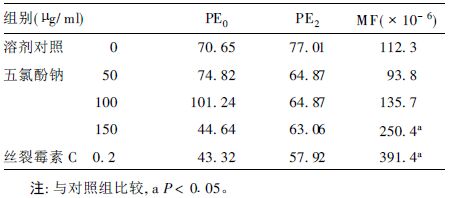
2.2 五氯酚钠诱导TK基因突变的试验结果(表 2)
该实验系统溶剂对照的PE0、PE2和MF分别为70.65%,77.01%,112.3×10-6,阳性对照的MF与溶剂对照差异有统计学意义(P<0.05) ,表明本试验系统可靠。结果表明,在测试浓度下,随染毒浓度增大,L5178Y细胞tk位点的突变频率有升高的趋势,其中150 μg/ml剂量组的突变率与对照组比较,差异有统计学意义(P<0.05) 。
| 表 2 五氯酚钠诱发TK基因突变频率(MF) |
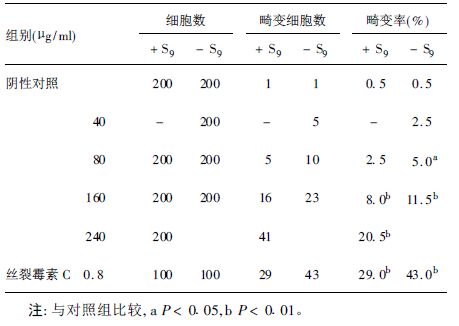
2.3 体外染色体畸变试验(表 3)
结果显示,无论是否加入代谢活化系统,五氯酚钠均有细胞毒性,引起染色体畸变率明显增加,与阴性对照组比较,差异有统计学意义(P<0.05) 。
| 表 3 五氯酚钠对CHO细胞染色体畸变试验结果 |
3 讨论
我国从20世纪60年代早期开始,曾在血吸虫病流行区域大量使用五氯酚钠,用于杀灭血吸虫的中间宿主-钉螺。随着科学的进步,五氯酚钠对环境的污染和对人体健康的危害日益受到了重视。目前对五氯酚钠的致突变型报道相对较少,尚无一致结论。对大鼠的研究发现,五氯酚钠被细胞色素P450酶代谢为亲电的活性产物后,会很快与邻近的蛋白或非蛋白巯基共价结合,但试验没观察到五氯酚钠及其代谢产物与DNA或血红蛋白结合的现象[8]。对小鼠有轻微的致突变效应,对人的淋巴细胞进行的五氯酚钠暴露培养发现了轻微的致突变性[9]。本研究发现,五氯酚钠对鼠伤寒沙门菌TA97、TA98、TM100、TA102试验菌株无论直接作用和代谢活化后作用,均未呈现致突变性;TK基因突变试验结果显示,五氯酚钠染毒小鼠淋巴瘤细胞L5178Y后,高剂量组TK位点基因突变频率明显升高,与对照组比较差异有统计学意义。体外染色体畸变结果显示,无论是否加入代谢活化系统,五氯酚钠均有明显细胞毒性,并能引起染色体畸变率的明显增加,且随着受试物剂量的增加,染色体畸变率呈明显增加的趋势。出现上述结果的原因可能是因为Ames试验仅能检测小的基因突变,而小鼠淋巴瘤细胞试验是以小鼠淋巴瘤L5178YTK+/-细胞中胸苷激酶基因突变频率为指标的基因突变试验,不仅能检测小的基因突变、染色体小的缺失,还能检测大的染色体畸变,而以往研究亦证明五氯酚钠对染色体有损伤作用。本研究结果提示,五氯酚钠能诱发体外细胞染色体畸变,是非基因致突变或弱基因致突变物。
| [1] | 冯亚平. 五氯酚对环境污染及居民健康影响的研究[J]. 四川环境, 1995, 14(1) : 34–38. |
| [2] | 郑星泉, 冯亚平, 江夕夫, 等. 血吸虫流行地区五氯酚的环境污染人体接触量及健康影响的研究[J]. 卫生研究, 1997, 26(1) : 24–29. |
| [3] | Gerhard I, Frick A, Monga B, et al. Pentachlorophenol exposure in women with gynecological and endocrine dysfunction[J]. Environ Res, 1999, 80 : 383–398. DOI:10.1006/enrs.1998.3934 |
| [4] | Pavlica M, Klobucar GIV, Moja N, et al. Detection of DNA damage in haemocytes of zebra mussel using comet assay[J]. Mutat Res, 2001, 490 : 209–214. DOI:10.1016/S1383-5718(00)00162-5 |
| [5] | 方征, 刘征涛, 李响, 等. 五氯酚钠与二恶英对人外周血淋巴细胞的影响[J]. 环境科学研究, 2006, 19(2) : 20–22. |
| [6] | Maron DM, Ames BN. Revised methods for the Salmonella mutagenicity test[J]. Mutat Res, 1983, 113 : 173–215. DOI:10.1016/0165-1161(83)90010-9 |
| [7] | 中华人民共和国卫生部.化妆品卫生规范[S].2002:114-117. |
| [8] | Jeong Yo-chan, Yoon Byoung-Su, Lee Yong-soon, et al. Covalent interactions of reactive pentachlorophenol metabolites with cellular macromolecules[J]. Korean J Toxicol, 1997, 13(3) : 257–263. |
| [9] | Draft Report,Atlanta G A.Toxicological profile for pentachlorophenol[R].U.S.Agency for Toxic Substance and Disease Registry,1992:75-79. |
 2008, Vol. 24
2008, Vol. 24