人体内牛磺酸的总量约占体重的0.1%。国内外学者对牛磺酸的研究发现,它不仅是人体的条件性必需营养素,而且具有广泛的生物学效应,是机体的内源性抗损伤物质。目前牛磺酸已经用于肝胆疾病、心血管疾病、糖尿病、白内障治疗等方面[1]。为探讨牛磺酸的抗肿瘤作用,2006年10~12月,本实验通过建立S180移植瘤小鼠动物模型,观察牛磺酸对其抗氧化能力影响,并探讨其作用机制。
1 材料与方法 1.1 材料(1) 牛磺酸(北京天天维他保健食品有限公司)。(2) 种鼠:S180肉瘤种鼠(山东医学科学院药物所)。(3) 实验动物及分组:60只健康昆明种断乳小鼠,体重25~45g(青岛市实验动物中心),许可证号:SCXK(鲁)20030010。本实验室动物房分笼适应性喂养1周后,随机分成5组。A、B、C组为牛磺酸低、中、高剂量组,分别在饮水中添加0.5%,1.0%,1.5%的牛磺酸,D组为环磷酰胺阳性对照组,E组为肿瘤阴性对照组。每组12只,雌雄各半,饲喂基础饲料。各组小鼠平均初始体重差异无统计学意义(F=0.747,P>0.05) 。(4) 其他试剂:环磷酰胺(上海华联制药有限公司);正常熔点琼脂糖(MP)、低熔点脂糖(LMP)、细胞培养液RPMI-1640(美国Gibco BRL公司);小牛血清(杭州四季青公司);淋巴细胞分离液(上海恒信化学试剂有限公司);荧光剂4,6-联脒-2-苯基吲哚(DAPI,美国Boehringer Mannheim公司);三羟甲基氨基甲烷(Tris,美国Amresco公司);1,6-Diphenyl-1,3,5-hexariene(DPH,美国Sigma公司);乙二胺四乙酸、磷酸二氢钠、磷酸氢二钠、氢氧化钠等为国产AR级试剂(青岛爱普生物制剂公司);超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒和考马斯亮兰贮备液以及蛋白标准(南京建成生物工程研究所)。
1.2 实验方法 1.2.1 动物肿瘤模型的建立选择腹腔接种S180移植瘤9d后的小鼠,抽取腹腔积液,经生理盐水稀释、计数(台盼蓝检查细胞活性大于95%)后于小鼠左前肢腋窝皮下接种S180细胞悬液0.2ml(细胞浓度为1.0×107/ml),24h后,阳性对照组小鼠腹腔注射环磷酰胺20mg/(kg·bw)。第8d小鼠称重后,眼眶取血待用,剥离肿瘤组织并剖取肝、脾、胸腺称重。
1.2.2 血浆、肝组织抗氧化物酶类及MDA的测定 1.2.2.1 肝匀浆的制备取新鲜肝组织称重后加入适量冰冷生理盐水,在冰浴中制备10%的匀浆。
1.2.2.2 检测方法肝蛋白质的测定采用考马斯亮蓝法。血浆和肝匀浆总SOD活性测定用黄嘌呤氧化酶法;MDA含量测定用硫代巴比妥酸比色法;GSH-Px活力测定用二硫代二硝基苯甲酸DTNB比色法;均按试剂盒说明书操作。
1.2.3 红细胞溶血度的测定取新鲜抗凝全血80μl,经生理盐水洗涤,离心3次,每次3000r/min离心5min,最后1次10min。去血浆及白细胞层,制成压积红细胞,加生理盐水配制成体积分数为10%的红细胞悬液。将每个样本的红细胞悬液分为A、B 2管,每管2.0ml。A管加2.0ml H202(终浓度为100mmol/L)混匀。B管加2.0ml蒸馏水混匀,上述2管各于37℃水浴箱水浴0.5h。离心3000r/min,5min,取上清液在540nm测吸光度值。溶血度(%)=(A管吸光度值/B管吸光度值)×100。
1.2.4 DNA氧化损伤的检测DNA损伤检测采用单细胞琼脂电泳(SCGE)方法[2]。取新鲜抗凝血35μl加入盛有基础培养基(RPMI-1640) 和体积分数0.1小牛血清的离心管中,0℃培养30min,取淋巴细胞分离液100μl加到该离心管的底部,4℃、200g离心3min,取粉红色淋巴细胞层移入盛有1000μl磷酸缓冲液的离心管中,分别加入0,5,10,25μmol/L的H2O2处理5min,离心12154r/min,3min,去上清,放入冰水浴中备用。取1%熔化的标准琼脂糖85μl滴于载玻片上,迅速盖上盖玻片,4℃冰箱放置15min。取1%熔化的低熔点琼脂糖85μl和上述淋巴细胞液混匀,取85μl的混悬液滴在第一层琼脂薄板上,迅速盖上盖玻片,4℃冰箱放置15min。然后放入溶解液中处理60min(4℃环境),放入电泳液内处理40min(4℃环境),电泳30min,用中和液中和3次,荧光剂(DAPI)染色,荧光显微镜下观察。每组观察100个细胞,计算其损伤单位。
1.3 统计分析采用SPSS 12.0软件进行统计分析,计量数据分析采用x±s,用单因素方差分析进行显著性检验并进行两两比较。所有假设检验均以α=0.05为检验水准。
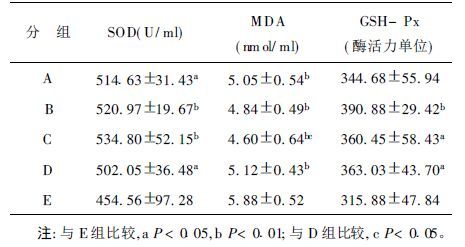
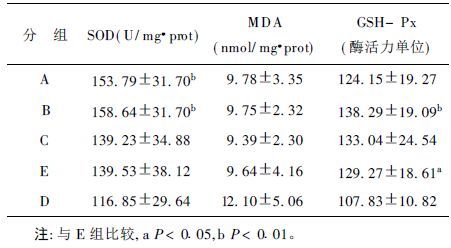
2 结果 2.1 血浆、肝组织抗氧化物酶类活力及MDA含量(表 1,2)牛磺酸各剂量组和阳性对照组的血浆、肝脏SOD活力与阴性对照组比较有所升高,除肝脏的牛磺酸高剂量组和阳性对照组外,其他各组的SOD活力与阴性对照组比较差异有统计学意义(血浆F=3.722,P<0.01;肝组织F=2.856,P<0.05) 。牛磺酸各剂量组和阳性对照组的血浆、肝脏GSH-Px活力与阴性对照组相比升高,且血浆、肝中的牛磺酸中剂量组和阳性对照组以及血浆的牛磺酸高剂量组与阴性对照组比较,差异有统计学意义(血浆F=3.563,P<0.05;肝组织F=4.455,P<0.01) ;牛磺酸各剂量组和阳性对照组的血浆、肝脏MDA含量较阴性对照组低,其中血浆牛磺酸各剂量组和阳性对照组与阴性对照组的差异有统计学意义,肝组织中的各组差异无统计学意义(血浆F=9.854,P<0.01) 。
| 表 1 各组小鼠血浆抗氧化指标比较(x ± s) |
| 表 2 各组小鼠肝组织抗氧化指标比较(x ± s) |
2.2 红细胞溶血度
牛磺酸各剂量组和阳性、阴性对照组的溶血度分别为(25.78±9.63) ,(26.73±8.48) ,(25.28±5.13) ,(23.16±7.11) ,(32.48±4.97) 。由此可见,牛磺酸各剂量组和阳性对照组的溶血度均低于阴性对照组,其中低、高剂量组和阳性对照组与阴性照组比较,差异有统计学意义(F=2.631,P<0.05) 。
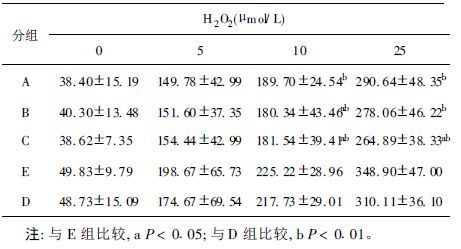
2.3 DNA氧化损伤结果(表 3)牛磺酸各剂量组的血淋巴细胞自发性损伤比阴性对照组低,但差异无统计学意义(F=1.830,P>0.05) 。在血淋巴细胞用5,10和25μmol/L H2O2处理后,观察牛磺酸各剂量组的DNA损伤较阴性、阳性对照组低;其中用10μmol/L H2O2处理的牛磺酸中、高剂量组和25μmol/L H2O2处理的牛磺酸高剂量组的DNA损伤与阴性对照组比较差异有统计学意义(F=3.513,P<0.05;F=5.366,P<0.01) 。
| 表 3 各组小鼠H2O2诱导的NDA氧化损化结果(x ± s) |
3 讨论
在各种物理、化学等环境因素造成机体损害或诱导细胞突变、癌变过程中,自由基及其引发的脂质过氧化作用起着十分重要的媒介作用[3, 4],正常情况下,自由基生成与清除之间的动态平衡是靠以SOD、GSH-Px为主的酶系统和非酶类抗氧化防御系统来维持。本实验发现,牛磺酸可明显提高荷瘤鼠血浆、肝中的总SOD和GSH-Px的含量,明显降低血浆MDA水平,提示牛磺酸能够提高机体抗氧化酶的活力,加强自由基的清除,减少脂质过氧化物MDA产生。通过H2O2诱导的氧化溶血实验发现,牛磺酸各剂量组的红细胞溶血度均下降,表明牛磺酸有稳定红细胞膜、抵抗氧化损伤的作用,与以往研究结果相似[5-8]。用5,10和25μmol/L H2O2处理血淋巴细胞后,牛磺酸各剂量组和阳性对照组的DNA损伤均较阴性对照组低,且中、高剂量的作用更为显著,提示牛磺酸有抗DNA氧化损伤的作用。与张峥[9]等报道牛磺酸可减轻紫外线对小鼠脾细胞DNA分子的损伤结果相似。
综上所述,牛磺酸通过提高机体的抗氧化酶活力,减少脂质过氧化物产生,保护红细胞膜,拮抗DNA氧化损伤机制来实现其对S180移植瘤的抗氧化作用。
| [1] | 袁国平, 陈赛贞. 牛磺酸应用研究进展[J]. 海峡药学, 2004, 16(3) : 20–23. |
| [2] | 秦椿华, 沈建英, 黄仕和, 等. DNA断裂检测方法-单细胞凝胶电泳法[J]. 生物化学与生物物理进展, 1995, 22(6) : 517–520. |
| [3] | Thomas SR, Neuzil J, Stocker R, et al. Coantioxidants make alpha-tocopherol an efficient antioxidant for low-density lipoprotien[J]. Am J Clin Nutr, 1995, 62(Suppl) : 1357–1364. |
| [4] | McCourt M, Wang JH. Taurolidine inhibits tumor cell growth in vitro and in vivo[J]. Annals of Surgical Oncology, 2000, 7(9) : 685–691. DOI:10.1007/s10434-000-0685-6 |
| [5] | 李金芳, 周荫庄, 屠淑洁. 牛磺酸对细胞的保护功能[J]. 首都师范大学学报, 2006, 27(1) : 63–65. |
| [6] | 周宝宽. 牛磺酸膜稳定作用的实验研究[J]. 中国药理学通报, 1997, 13(3) : 277. |
| [7] | 刘雪芬, 莫忠贤, 陈晓佳. 牛磺酸对大鼠红细胞的保护作用[J]. 中国应用生理学杂志, 1995, 11(2) : 190–191. |
| [8] | 张秀珍, 杜卫, 沈芳兰, 等. 牛磺酸对小鼠移植瘤S180肉瘤影响的研究[J]. 卫生研究, 1997, 26(5) : 321–324. |
| [9] | 张峥, 张秀珍, 李珏声, 等. 牛磺酸对小鼠脾细胞DNA损伤的影响[J]. 青岛医学院学报, 1999, 35(2) : 92–93. |
 2008, Vol. 24
2008, Vol. 24