DNA加合物是化学毒物经生物系统代谢并活化后的亲电活性产物与DNA分子特异位点结合形成的共价结合物,是DNA化学损伤的最重要和最普遍形式。目前认为外源化合物与DNA发生共价结合,形成的结合物一旦逃避自身的修复,就可能导致某些特异位点的基因突变。因此,DNA加合物的形成被认为是致肿瘤过程的一个重要阶段。它可以作为接触生物标志物,反映毒物到达靶位的内接触剂量;又可以作为一种效应标志物,反映DNA受到有毒化学物质损伤的效应剂量[1, 2]。近年来,DNA加合物的研究已成为现代毒理学领域的研究热点,在生物监测中具有重要意义,成为近年来研究和应用最多的一种分子水平的暴露标志物。现就当前检测方法研究进展综述如下。
1 传统检测方法 1.1 加速器质谱法(AMS)AMS是测试同位素比的一种高灵敏度方法,而同位素比测试法常用于检测DNA加合物。AMS法测量放射性标记的化学物可精确到痕量分子水平,精确度达几个加合物/10核苷酸水平。目前已应用AMS研究接触致癌物的人群所形成加合物的剂量-反应关系,王艳等[3]采用加速器质谱法研究小鼠血液中血红蛋白(Hb)、白蛋白(SA)和尼谷丁的加合作用,发现2种蛋白的尼古丁加合物水平都随着尼古丁剂量升高而呈线性增加。用一定剂量的环境致癌物染毒后发现,动物和接触人群的加合物尽管存在同样类型,但其水平存在差异。AMS检测的代谢物和个体加合物,有助于解释低剂量水平下生物化学作用机制,该方法用于剂量测定、检测接触低剂量水平暴露下的实验动物或人群加合物含量,有助于物质危险度评估和作为致癌物的加合物含量及人群研究终点的加合物检测接触生物标志物的评定。
1.2 连接物介导的聚合酶链反应(LMPCR)法连接物介导的聚合酶链反应是一种以PCR技术为基础检测哺乳动物基因单个核苷酸的DNA加合物方法。用诸如T4内切酶V(T4endonuclease V)、碱基切除修复酶系统、UvrABC核酸酶和化学裂解法将加合物转化为DNA链并使其断裂,然后用连接物介导的聚合酶链反应检测断裂位置。该方法已用于标记紫外线辐射致DNA损伤的分布、多环芳烃和黄曲霉毒素B致DNA损伤加合物的检测。P53突变的数据库中其突变的多样性,提供了环境诱变剂在人类肿瘤发生作用的间接依据。PfeiferGP假设选择性在P53突变蛋白中央区发生特异性突变的作用不大,环境致癌剂引起的DNA损伤是沿着P53基因分布的,它与某些肿瘤的P53基因突变谱,即突变的热点和类型相关。目前从日光和香烟成分中苯并(a)芘代表的多环芳烃类致癌剂所进行的实验得到证实。上述突变剂实验所获得的损伤/修复相关数据为人类非黑色素瘤的皮肤癌和因吸烟导致的肺部肿瘤的突变谱提供一定的预测参数。
1.3 32P后标记法(32P-Postlabelling)(图 1)32P-后标记法是1981、1982年由Randerath和Gupta等[4, 5]首先建立的一种DNA加合物检测分析方法,经过近20年发展与完善,目前已成为灵敏度最高应用最为广泛的DNA加合物测定方法。这种方法的基本步骤包括:(1)将完整的DNA降解为脱氧3′-单核苷酸;(2)在T4多聚核苷酸激酶的作用下,将32P标记到单核苷酸的5′端,使之形成3′,5′-二磷酸核苷;(3)多向薄层层析(TLC)分离出32P标记的加合物;(4)通过放射活性测定加合物的含量。以后经过逐步改进,在32P标记前利用各种方法来浓缩富集被加合的核苷,从而使方法的灵敏度不断提高。32P后标记分析测试DNA加合物可以对所测试的加合物进行定量,用标准品确定该方法的回收率。该方法虽然重现性好,但不安全,且有污染性。
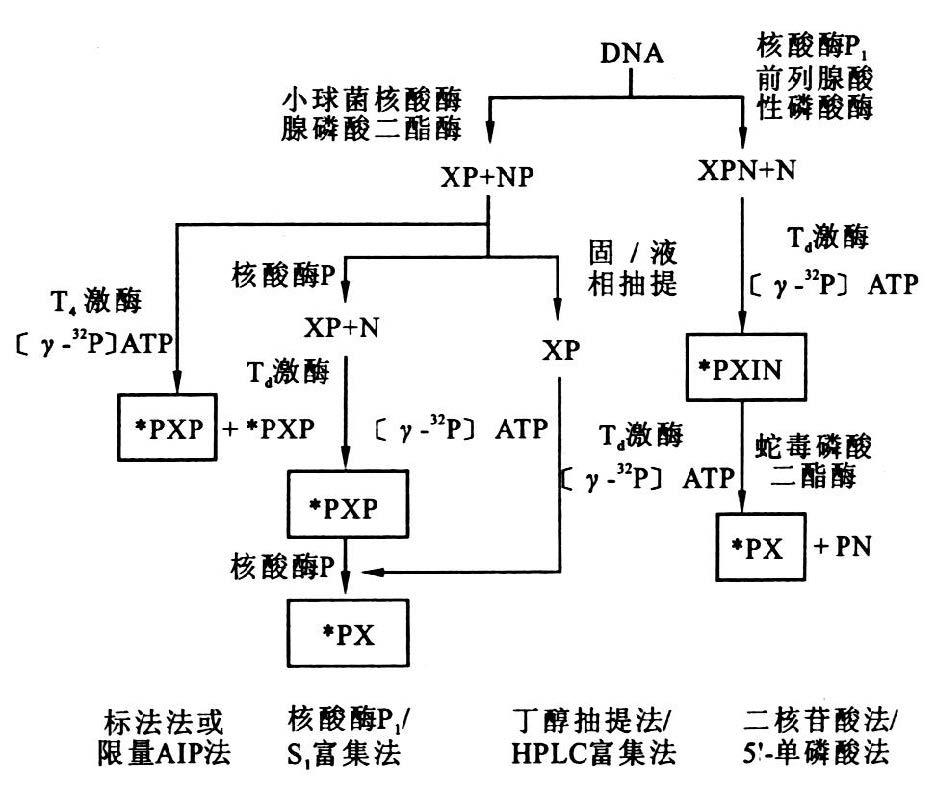
|
图 1 32P-后标记法 |
1.4 碱洗脱法
这是一种用来检测特殊DNA加合物或称特殊损伤的一种技术,即DNA交联。目前许多化学致癌物均先引起DNA交联而后产生致癌作用。其基本原理是基于Kohn的洗脱率[6]。其主要方法是将细胞与化学物一起孵育,然后移去受试物,将细胞悬液用3或6Gy的X射线照射,裂解细胞以释放DNA,经一定孔径的滤膜过滤,照射的功能是使DNA链断裂,交联的DNA因滞留于滤膜上而洗脱较慢。利用特殊孔径的滤膜可以将DNA-DNA交联、DNA-蛋白质交联与其他的DNA损伤区分开来。
1.5 核磁共振法核磁共振法是常用的分析化学物结构的方法,对DNA加合物结构的分析常用的是二维核磁共振波谱法(2D-NMR),2D-NMR已成为检测水溶性双链DNA结构的强有力工具,利用2D-NMR波谱具有短距离作用的特性,可精确确定双链DNA小片段的三维结构,检测带有加合物的核苷定位和构型特征。但此法主要缺点是所需的样品量比较大[7]。
2 新近检测方法 2.1 纳米探针测定法Tuan Vo-Dinh等[8]将以抗体为基础的纳米探针应用于现场单细胞测定。这种抗体是一种荧光分析物--苯并芘四醇(BPT),即致癌物苯并芘的代谢产物或是苯并芘与DNA的加合物,这种物质可以作为一种生物标记物用于由于暴露苯并芘[B(a)P]导致的DNA损伤监测,并做出可能的癌前诊断。测定在大鼠肝上皮细胞9代细胞系进行。在测定前,细胞要先用浓度为(9.6±0.2) ×1011M的BPT孵育5min,以利于抗原-抗体结合。这项技术还可扩展用于非荧光抗原测定,即在多层免疫测定法中加用一个荧光标记抗体或应用荧光标记抗原进行竞争性结合测定。
2.2 微流控芯片法微流控芯片最早出现于20世纪90年代早期[9-14]。微流控芯片在许多方面优于标准毛细管电泳,包括试剂和样本消耗少[9, 10]、效率高[12]、速度快、通量大、便携性好、整合性强及自动化程度高[9, 10]。Dawood等[14]应用微流控芯片及电化学检测系统分离鉴别多巴胺诱生的DNA加合物及各种儿茶酚胺类。用传统技术很难精确的检测分离酪氨酸、多巴胺、左旋多巴及多巴胺诱生的DNA加合物。但Dawood等[14]人将微流控芯片改进后,成功化解了这一难题。
2.3 高效液相色谱(HPLC)法高效液相色谱是目前许多实验室普遍拥有的设备,操作简单,分离效果好,其附带紫外检测器和荧光检测器能够有效检测出具有紫外特定波长吸收特征和荧光特性的物质。袭著革等[15]应用液相色谱-电化学法研究丙烯醛致DNA分子产生氧化损伤标志物8-羟基脱氧鸟苷(8-OHdG)。结果表明,丙烯醛可诱导人外周血淋巴细胞DNA发生链断裂,但不引起DNA-DNA、DNA-蛋白质交联;丙烯醛与小牛胸腺DNA的体外作用较弱,但在铁离子介导下对DNA的氧化能力增强,可产生一定量的8-OHdG加合物。刘渠等[16]用高效液相色谱法探讨体外合成苯并(a)芘与DNA形成加合物的条件,初步确定了DNA加合物的生成。
3 结语DNA加合物作为接触生物标志物和效应生物标志物可用来进行环境生物监测和评价,它弥补了传统方法的局限性。DNA加合物的检测对毒理学、职业病学和流行病学发展日趋重要,分子生物学理论和技术的迅速发展给毒理学带来研究契机,这种革新给疾病的预防及控制带来了潜力。一些关键性的酶类、受体和基因已先后被发现、定性甚至克隆,将有利于DNA加合物的检测。因此,上述技术必将会进一步的发展和完善,会出现更多的检测手段,为不同的研究提供帮助。
| [1] | 夏世均, 吴中亮. 分子毒理学基础[M]. 武汉: 湖北科学技术出版社, 2001: 614-618. |
| [2] | 张雪梅, 杨文敏, 张志. 大气颗粒有机提取物所致小鼠DNA 加合物与微核的相关关系研究[J]. 中国公共卫生, 2001, 1(17) : 11–12. |
| [3] | 王艳, 王海芳, 孙红芳, 等. 加速器质谱法研究尼古丁与小鼠血液蛋白的加合作用[J]. 高等学校化学学报, 2002, 23(5) : 809–812. |
| [4] | Randerath K. 32P-labeling t est for DNA damage[J]. Proc Nat l Sci USA, 1981, 78 : 6126. DOI:10.1073/pnas.78.10.6126 |
| [5] | Gupt a R C. 32P-postlabelling analysis of non-radioact ive aro[mat ic carcinogen-DNA aducts[J]. Carcinogenesis, 1982, 3 : 1081. DOI:10.1093/carcin/3.9.1081 |
| [6] | 居学海, 张琪, 戴乾圜. 致突变的致癌剂和非致癌剂在引发 DNA 股间交联上的显著差别[J]. 环境化学, 2001, 20(6) : 537–543. |
| [7] | 邵华, 李杰, 师以康. 苯乙烯-DNA 加合特性的研究[J]. 中华劳动卫生职业病, 2002, 20(5) : 347–349. |
| [8] | Tuan Vo-Dinh, Jean-Pierre Alarie, Brian M Cullum, et al. Antir body-based nanoprobe for measurem ent of a fluorescent analyte in a single cell[J]. Nature Biotechnologe, 2000, 18 : 764–767. DOI:10.1038/77337 |
| [9] | Bruin GJ. Recent developments in elect rokinetically driven analysis on microfabricat ed devices[J]. Electrophoresis, 2000, 21 : 3931–3951. DOI:10.1002/(ISSN)1522-2683 |
| [10] | Mello A. On-chip chromat ography:the last 20 years[J]. Lab Chip, 2002, 2 : 48–54. DOI:10.1039/b207266c |
| [11] | Lacher NA, Garrison KE, Mart in RS, et al. Microchip capillary elect rophoresis/elect rochemist ry[J]. Elect rophoresis, 2001, 22 : 2526–2536. DOI:10.1002/(ISSN)1522-2683 |
| [12] | 方肇伦, 方群. 微流控芯片发展与展望[J]. 现代科学仪器, 2001, 4 : 3–6. |
| [13] | Wilke R, But tgenbach S. M icromachined capillary elect rophoresis chip with fully integrated electrodes for separation and electrochemical detection[J]. Biosens Bioelectron, 2003, 1 : 149–153. |
| [14] | Dawoud A A, Kawaguch i T, Markushin Y, et al. Separation of catecholamines and dopamine-derived DNA adduct using a microfluidic device with electrochem ical detection[J]. Sensors and Actuators, 2006, 1 : 1–9. |
| [15] | 袭著革, 晁福寰, 杨丹凤, 等. 丙烯醛对DNA 分子的损伤作用[J]. 环境与健康, 2004, 21(5) : 293–295. |
| [16] | 刘渠, 杨柳桦, 林琳, 等. BPDE-DNA 加合物体外生成实验研究[J]. 现代预防医学, 2006, 33(12) : 2251–2253. |
 2008, Vol. 24
2008, Vol. 24

