孕妇感染乙肝病毒后,可能垂直传播给胎儿,目前乙型肝炎垂直传播是我国人群传播的重要途径[1],已成为严重的公共卫生问题和社会问题。Toll样受体3(Toll like receptor 3,TLR3)是公认的与病毒感染关系较为密切的一种病原体相关分子模式(PAMP)识别受体,在抗病毒免疫反应中发挥重要作用[2, 3]。本研究通过检测TLR3 mRNA在外周血HBsAg阳性孕妇和正常孕妇胎盘表达的差异及TLR3受体在2组孕妇胎盘分布差异,了解TLR3与孕妇HBV感染的关系,探讨TLR3在HBV感染中的作用。
1 材料与方法 1.1 标本来源及分组2006年11~12月,从太原市传染病院妇产科选取外周血HBsAg阳性的足月分娩孕产妇胎盘共14份作为RT-PCR检测的病例组,同期从山西医科大学第一医院妇产科收集正常健康足月分娩孕产妇胎盘22份作为对照组;免疫组化检测的病例组除新收集的14例新鲜胎盘外,还有2004年从太原市传染病院妇产科收集的102份HBsAg阳性孕妇足月胎盘组织蜡块,共116分;对照组41份,由山西医科大学第一医院妇产科收集的19份正常孕产妇足月胎盘组织蜡块及新收集的22份胎盘组成。病例组除HBV感染外无其他疾病,对照组与病例组在年龄、民族等方面分布差异无统计学意义。
1.2 主要材料Trizol总RNA提取试剂盒和逆转录-聚合酶链反应(RT-PCR)试剂盒(大连宝生物工程有限公司);DNA Marker(北京博迈德科技发展有限公司);酶联免疫吸附试验(ELISA)试剂盒(上海科华实业总公司);免疫组织化学试剂鼠抗人TLR3(美国Santa cruz公司);生物素化鼠抗人ABC试剂盒(美国Vector Laboratories,INC)。引物由上海生物工程有限公司合成。
1.3 实验方法(1)标本处理:于自然分娩或剖宫产当时迅速无菌收集胎盘,每份标本一部分置于-80℃保存备RNA提取用,一部分置于4%多聚甲醛中固定,常规石蜡包埋,做4~5 μm切片备用。(2)胎盘组织RNA提取:按Trizol总RNA提取试剂盒说明书进行,RNA样品于-80℃保存。(3)半定量RT-PCR技术检测胎盘组织TLR3 mRNA的表达:按RT-PCR产品试剂盒说明书推荐的方法合成cDNA第一条链,逆转录体系:每个样本加入MgCl2 2 μl,10×反应缓冲液1 μl,无RNA酶的蒸馏水3.75 μl,脱氧核苷三磷酸(dNTP) 混合物(各10 mmol/L) 1 μl,RNA酶抑制剂0.25 μl,AMV逆转录酶0.5 μl,TLR3(orβ-actin )引物0.5 μl,RNA 1 μl,总体积10 μl/Sample;逆转录条件为:30℃ 10 min,42℃ 30 min,99℃ 5 min,5℃ 5 min;PCR反应体系:每个样本加入5×反应缓冲液10 μl,灭菌蒸馏水 28.75 μl,Taq聚合酶 0.25 μl,上游引物0.5 μl,下游引物0.5 μl,总体积40 μl;把PCR反应液加入到逆转录反应结束后的PCR反应管中,轻轻混匀。按以下条件进行PCR反应:94℃ 2 min,94℃ 30 s×35,55℃ 30 s×35,72℃ 1 min×35。反应结束后,取PCR反应液10 μl进行琼脂糖凝胶电泳,确认PCR产物。胎盘TLR3 mRNA的半定量以β-肌动蛋白(β-actin)作为内参照。TLR3上游引物序列:5′-gtt tgg agc acc tta aca tgg aa-3′(1168~1190),下游引物序列:5′-tgc tta gat cca gaa tgg tca ag-3′(1644~1622),扩增片段长度为477 bp;β-actin上游引物序列:5′-agc gag cat ccc cca aag tt-3′(1380~1399),下游引物序列:5′-ggg cac gaa ggc tca tca tt-3′(1664~1645),扩增片段长度为285 bp。PCR产物在6 V/cm电压下经1.7%琼脂糖凝胶电泳成像,用Vilber Lourmat凝胶成像系统的Bio-capt图像分析软件分析电泳条带的吸光度(A)值,以TLR3与β-actin A值的比值×100%表示TLR3 mRNA的相对表达水平。(4)免疫组织化学ABC法检测胎盘组织TLR3受体的分布:组织切片55℃烘烤12 h后,常规石蜡入水,同时设空白对照和阴性对照,按试剂盒说明书操作,二氨基联苯氨(DAB)显色后显微镜观察并照相,组织切片中棕黄色免疫印迹判定为TLR3阳性。
1.4 统计分析应用SPSS 12.0软件进行数据处理。
2 结果 2.1 胎盘组织TLR3mRNA的表达情况 用半定量RT-PCR技术检测HBsAg阳性孕妇和正常孕妇胎盘组织TLR3基因的表达情况,病例组TLR3吸光度比值(TLR3/β-actin)平均值为0.417 5±0.221 6,对照组为0.638 7±0.205 3,TLR3 mRNA在HBsAg阳性孕妇组的表达低于正常孕妇组(t=3.003,P<0.05)。RT-PCR产物电泳结果见图 1。

|
注:M:PCR Marker,从上至下依次为:600,500,400,300,200,100bp;1:β-actin (285bp);2:TLR3 (477bp) 图 1 RT-PCR产物1.7%琼脂糖凝胶电泳图 |
2.2 胎盘组织TLR3受体分布情况
用免疫组织化学ABC法检测HBsAg阳性孕妇和正常孕妇胎盘组织TLR3受体的分布情况。所检41例正常孕妇胎盘,TLR3受体全部阳性,且各层细胞均显示很强的免疫印迹,呈片状分布,以胞浆分布为主,偶见于胞膜和胞核(图 2);所检116例HBsAg阳性孕妇胎盘中,85例TLR3受体阳性,阳性率为73.0%,棕黄色阳性信号局灶性分布于被检胎盘的各型细胞中,大多位于胞浆,偶见于胞膜和胞核(图 3)。TLR3受体在病例组胎盘和对照组胎盘分布经检验差异有统计学意义(χ2 =12.018,P=0.001),TLR3高表达是孕妇HBV感染的保护因素(OR=0.733,95%CI=0.656~0.818)。
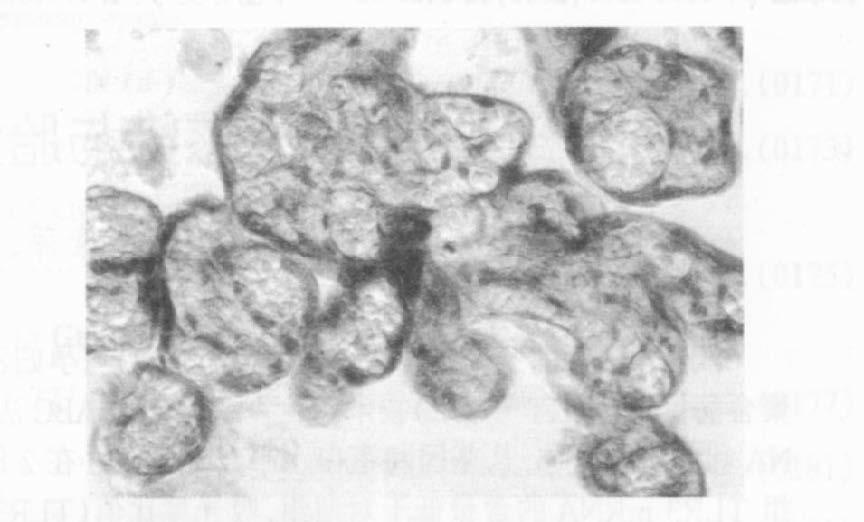
|
注:滋养层细胞、绒毛间质细胞和毛细血管内皮细胞胞浆棕黄色信号显示TLR3(苏木素衬染,×400)。 图 2 免疫组织化学ABC法检测正常孕妇足月胎盘TLR3 |

|
注:滋养层细胞、绒毛间质细胞和毛细血管内皮细胞胞浆棕黄色信号显示TLR3 (苏木素衬染,×400)。 图 3 免疫组织化学法检测HBsAg阳性孕妇足月胎盘TLR3 |
3 讨论
Toll样受体(Toll-like receptors,TLRs)是近年来新发现的天然免疫系统中病原体模式识别受体(PRR)[4],在辨识和抵御不同外来病原微生物的免疫反应中发挥重要作用。研究认为,TLR3是较公认的与病毒感染关系较为密切的一种病原体相关分子模式识别受体,在抗病毒免疫反应中发挥重要作用[2, 3]。TLR3受体主要分布在人类胎盘和胰腺组织[4, 5],病毒的双链RNA(dsRNA)是TLR3的配体,病毒感染人类组织细胞,导致天然免疫系统活化。病毒在感染的细胞内复制产生dsRNA,TLR3能特异性地辨识dsRNA,通过髓样分化因子(MyD88)依赖和非依赖途径介导信号转导,有活化补体、吞噬作用、启动细胞活化和炎性信号转导、诱导凋亡等生物学功能,参与机体的抗病毒免疫反应[2]。
通过半定量RT-PCR技术检测发现,HBsAg阳性孕妇的胎盘组织中TLR3 mRNA的表达显著低于正常对照组;通过免疫组织化学法检测发现,胎盘各型细胞均可检出TLR3的存在,表明胎盘在防御病毒侵袭的天然免疫系统中起着重要的作用。HBsAg阳性孕妇的胎盘组织中TLR3受体阳性率低于正常孕妇组。结果提示,胎盘TLR3表达情况与孕妇HBV感染有关。(1)TL3受体可能是孕妇HBV感染的保护因素之一。由于宿主体内TLR3基因及蛋白的表达较低,导致机体抗病毒功能低下,在遭遇病毒入侵时难以进行有效抵御与攻击,引发机体HBV感染;(2)或者由于乙肝病毒的侵入,孕妇体内HBV的刺激持续存在,从而导致TLR3基因和蛋白表达下调。TLR3低表达与孕妇HBV感染关系尚需进一步研究。
| [1] | 李莹, 李文凡. 乙型肝炎垂直传播及阻断措施的研究现状[J]. 中华传染病杂志, 2006, 24(2) : 130–132. |
| [2] | Zhou S, Kurt-Jones EA, Mandell L, et al. MyD88 is critical for the development of innate and adaptive immunity during acute lympho2 cytic choriomeningitis virus infection[J]. EUR J Immunol, 2005, 35(3) : 22–30. |
| [3] | Ashkar AA, Yao XD, Gill N, et al. Toll-like receptor ( TLR)-3,but not TRL4,agonist protects against genital herpes infection in the absence of inflammation seen with CpG DNA[J]. J Infect Dis, 2004, 190(10) : 1841–1849. DOI:10.1086/jid.2004.190.issue-10 |
| [4] | Schulz O, Diebold SS, Chen M, et al. Toll-like receptor 3 promotes cross-priming to virus-infected cells[J]. Nature, 2005, 433(7028) : 887–892. DOI:10.1038/nature03326 |
| [5] | Masuhiro N, Shinsaku N. Tissue-specific mRNA expression profiles of human toll-like receptors and related genes[J]. Biol Pharm Bull, 2005, 28(5) : 886–892. DOI:10.1248/bpb.28.886 |
 2008, Vol. 24
2008, Vol. 24

 , 原琛利, 宋秀霞, 车小文
, 原琛利, 宋秀霞, 车小文