2. 辽宁省职业病防治院
有文献报道,慢性砷暴露可引起体内氧化应激反应增强,活性氧(ROS)生成增多,造成DNA链的断裂或加合物的生成,并对机体的抗氧化系统造成影响[1]。砷中毒严重危害人类的健康,但是目前仍缺乏有效的治疗措施。硒是人体和动物以及哺乳动物细胞体外培养所必需的元素[2],并且人群和动物实验均证实了硒的抗癌作用。硒可增加砷在大鼠胆汁内的排泄,减少砷所致的微核发生率,拮抗砷所致人外周血淋巴细胞遗传毒性[3]。维生素C具有清除自由基的作用,保护机体免受氧化应激的损伤。动物实验表明,维生素C与其他抗氧化物联合作用可改变砷在大鼠体内的氧化应激状态以及对抗氧化系统的损伤,并拮抗砷对体外培养细胞的毒性[4]。本研究检测不同浓度的亚砷酸钠对大鼠淋巴细胞的毒性作用和氧化损伤,并加入一定浓度的NaSeO3和维生素C探讨其对砷致细胞毒性的拮抗作用,为地方性砷中毒的防治提供参考依据。
1 材料与方法 1.1 材料 1.1.1 实验动物健康雄性Wistar大鼠,体重(250±20)g(大连医科大学实验动物部)。
1.1.2 试剂和仪器(1)主要试剂:NaAsO2,分析纯(上海试剂二厂);NaSeO3,分析纯(沈阳市试剂二厂);27-二乙酰二氯荧光素(DCFH-DA)(美国Sigma公司);维生素C,分析纯(沈阳市试剂二厂);淋巴细胞分离液(上海试剂二厂);硫代巴比妥酸(日本和光纯药工业株氏会社);RPMI 1640培养基(美国Gibco公司);(2)主要仪器:超净工作台(苏净集团安泰公司);二氧化碳培养箱(荷兰Heraeus公司);倒置相差显微镜(日本Olympus公司);F2500荧光分光光度计(日本Hitachi公司);流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 大鼠淋巴细胞的分离用乙醚麻醉Wistar雄性大鼠,经腹主动脉采血7ml,Ficoll-Hypaque梯度密度离心法分离淋巴细胞:以RPMI 1640等体积稀释血液,按2:1体积比将稀释血液层叠于淋巴细胞分离液上,3000r/min离心30min,吸出中间絮状的淋巴细胞层,磷酸盐缓冲液(PBS)洗涤2次,调节细胞浓度至3×106/ml左右备用。
1.2.2 细胞处理将100l细胞悬液以1×105/孔加入96孔板中,每组设4个复孔,部分孔分别加入5和10mol/L的NaSeO3或50和100mol/L的维生素C,置于37℃,50%CO2恒温培养箱中培养24h后加入0,0.1,1,10,100mol/L的NaAsO2。
1.2.3 ROS含量检测利用荧光探针2',7'-二乙酰二氯荧光素(DCFH-DA)测细胞内ROS的形成,所用的DCFH-DA是一种非极性荧光染料,可自由通过细胞膜,进入细胞后被细胞内非特异性酯酶去酯水解成无荧光的二氯荧光素(DCFH),被细胞内的各种淋巴活性氧群(ROS)氧化后形成发荧光的二氯荧光素(DCHF),细胞内DCHF的荧光强度反映了细胞内的ROS含量:淋巴细胞用各浓度的NaAsO2作用24h后,用PBS洗2次,加入10mol/L的DCFH-DA10l,在37℃下孵育20min,然后用胰酶消化,PBS洗2次后用荧光分光光度计激发光485nm、狭缝5nm,发射光530nm、狭缝10nm测定各组细胞悬液及无细胞对照组中二氯荧光素(DCHF)的荧光强度。
1.2.4 蛋白浓度的测定用Bradford法测定蛋白浓度:将蛋白测定浓缩液与双蒸水按1:4稀释,用牛血清白蛋白配制蛋白标准,线性范围在0.2~0.9mg/ml,将细胞用超声粉碎仪打碎,取60l蛋白标准液或样品溶液,加入3ml蛋白测定稀释液,振荡,室温放置5min,在595nm处检测吸光度值,根据蛋白标准曲线,计算样品的蛋白浓度。
1.2.5 细胞内脂质过氧化物(LPO)含量的测定收集处理后的细胞,用PBS洗涤2次,冰浴中超声破碎细胞,4℃,10000g离心20min,取上清。硫代巴比妥酸荧光法测定丙二醛(MDA)含量,激发波长为515nm,发射波长为550nm。
1.3 统计分析采用SPSS 11.0统计软件,用单因素方差分析(ANOVA)比较各实验组与对照组间的差异。
2 结果 2.1 NaSeO3和维生素C预处理对砷致细胞ROS含量影响当NaAsO2浓度>10mol/L时,细胞内的DCF荧光强度明显强于对照组(P>0.01),且呈剂量-反应关系。用NaSeO3预处理后,可降低砷处理组的DCF荧光强度,10mol/L NaAsO2处理组的DCF荧光强度降至正常水平,但100mol/L NaAsO2处理组的DCF荧光强度未达到正常水平;用维生素C预处理后,可降低NaAsO2处理组的DCF荧光强度,但10和100mol/L NaAsO2处理组的DCF荧光强度均未降至正常组水平。
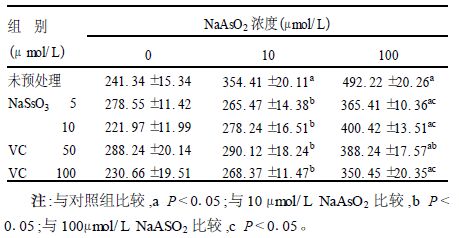
2.2 NaSeO3和维生素C预处理对砷致MDA含量影响(表 1)10和50mol/L的NaAsO2使细胞内的MDA含量增高(P>0.01);用NaSeO3预处理后,砷处理组的MDA含量减少,10mol/L NaAsO2处理组的MDA含量降至正常水平,但100mol/L NaAsO2处理组的MDA含量未达到正常水平;用维生素C预处理的作用效果与NaSeO3预处理基本相同。
| 表 1 NaSeO3和维生素C预处理后细胞内MDA含量变化〔nmol/ ( g prot) , x ±s , n = 4〕 |
3 讨论
体外实验发现,砷作用于细胞后可产生多种ROS。动物实验表明,急慢性砷暴露可引起大鼠血液、肝脏、肾脏和其他脏器的LPO生成增多[5]。本研究结果表明,砷暴露可增加大鼠淋巴细胞的ROS含量,并使MDA含量增多,提示砷暴露所诱导的氧化应激在人群砷中毒和癌症的发生过程中可能起重要作用。
有报道表明,高砷地区伴有低硒,砷中毒病人血硒水平低于正常人,适当剂量的硒能拮抗一定浓度的砷对抗氧化酶活性的抑制[6]。本研究结果显示,硒可拮抗无机砷所诱导的大鼠淋巴细胞毒性作用,包括对细胞活力的影响和对细胞的氧化应激作用,提示其在砷中毒治疗中可能发挥的有效作用。硒是谷胱甘肽过氧化物酶的重要组分部分,硒的加入有可能通过酶活性的提高而拮抗砷的毒性,硒还可抑制氧化应激所诱导的AP-1和NF-B等信号转导途径[7]。
维生素C拮抗砷毒性的作用不如NaSeO3明显,可能其发挥抗氧化作用主要是与其他物质协同作用,如维生素E等。而过量摄入维生素C也可引起一系列的副作用,临床上也常见维生素C中毒的报道。本实验中为2种抗氧化物为生理浓度,因而对细胞本身无明显的毒性作用。抗氧化物对砷的拮抗作用研究仍需不断深入,以便早期确定其对砷中毒的疗效,为我国地方性砷中毒的有效防治奠定基础。
| [1] | Mouron SA, Grillo CA, Dulout FN, et al. Induction of DNA strand breaks, DNA-protein crosslinks and sister chromatid exchanges by arsenite in a human lung cell line[J]. Toxicol In V it ro, 2006, 20 : 279–85. |
| [2] | Zeng H. Selenite and selenomethionine promote HL-60 cell cycle progression[J]. J Nutr, 2002, 132 : 674–679. |
| [3] | Verret WJ, Chen Y, Ahmed A, et al. A randomized, double-blind placebo-controlled trial evaluating the effects of vitamin E and se2 lenium on arsenic-induced skin lesions in Bangladesh[J]. J Occup Environ Med, 2005, 47 : 1026–1035. DOI:10.1097/01.jom.0000183095.45050.97 |
| [4] | Nandi D, Patra RC, Swarup D. Effect of cysteine, methionine, ascorbic acid and thiamine on arsenic-induced oxidative stress and biochemical alterations in rats[J]. Toxicology, 2005, 211 : 26–35. DOI:10.1016/j.tox.2005.02.013 |
| [5] | Shi H, Hudson L G, Ding W, et al. Arsenite causes DNA damage in keratinocytes via generation of hydroxyl radicals[J]. Chem Res Toxicol, 2004, 17 : 871–878. DOI:10.1021/tx049939e |
| [6] | Flora SJ S. arsenic-induced oxidative stress and its reversibilit y fol2 lowing combined administration of N-acetylcysteine and meso 2, 3-dimercapto-succinic acid in rats[J]. Clin Exp Pharmacol Physi2 ol, 1999, 26 : 865–869. DOI:10.1046/j.1440-1681.1999.03157.x |
| [7] | Zeng H, Eric OU, Gerald FC J r. Mechanistic aspects of the interac2 tion between selenium and arsenic[J]. J Inorg Biochem, 2005, 99 : 1269–1274. DOI:10.1016/j.jinorgbio.2005.03.006 |
 2008, Vol. 24
2008, Vol. 24