2. 新疆乌鲁木齐市血液中心
β-地中海贫血是一类严重危害人民健康的遗传性疾病,我国新疆的广大地区属于高发区[1, 2]。为预防控制该病,除了做好遗传咨询、婚配指导及改进治疗方法外,最根本的措施是杜绝患儿出生,为此必须进行产前诊断。根据β-珠蛋白基因(β-Gg)家族的限制性内切酶酶切位点多态性性质进行β-地中海贫血的产前诊断,目前更被认为是一种最佳的方法[3-5]。国外进行这方面研究工作已有20~30年,但是我国则刚刚起步。由于世界上不同种族、封闭群体在某些遗传学特征上的可能差异,其β-珠蛋白基因家族内各基因多态性性质也可能有所差异。因此,为了观察新疆人β-珠蛋白基因家族内各基因多态性酶切位点的分布,本文选择新疆克里雅河下游封闭人群(克里雅人),探讨新疆封闭克里雅人β-珠蛋白基因大内含子序列中AvaII酶切位点的多态性。
1 对象与方法 1.1 对象在塔克拉玛干沙漠腹地克里雅河下游的封闭人群中,随机选取符合条件的健康克里雅居民进行调查。个体之间无直接血缘关系,经健康体检排除代谢系统疾病及心血管、肺、肝、肾、脑等重要器官肿瘤及急慢性疾病,共调查54人,其中男性34人,女性20人,年龄14~70岁。
1.2 方法 1.2.1 调查与采样调查时间为2004年6月,由乌鲁木齐市血液中心专业人员采用课题组自行设计的统一调查表进行流行病学问卷调查。根据知情同意的原则,采取现场面对面直接询问的方法。同时在无菌操作条件下,静脉采血样5ml,乙二胺四乙酸二钠盐(EDTA)抗凝管收集,-20℃保存。
1.2.2 基因组DNA提取及定量采用盐析法从冻存血液中提取DNA,用无水乙醇或异丙醇沉淀、纯化、置室内自然干燥,加三羟甲基氨基甲烷-乙二胺乙酸二钠(TE)缓冲液50~100 l备用。依据SmartSpect核酸蛋白测定仪(美国Bio-Rad公司)定量的结果,用TE缓冲液稀释样本DNA浓度至50~100 ng/l。
1.2.3 β-珠蛋白AvaII位点基因多态性检测采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术进行DNA扩增,(1)引物:β-Gg-F 5'-TCCCCAGTTAACCTCCTATT-3';β-Gg-R 5'-GCTTGGACTCAGAATAATCC-3',由上海生工生物技术有限公司合成。(2)PCR反应液组份:1 l DNA模版含有50~100 ng基因组DNA;16.3 l H2O;10倍PCR缓冲液2.5 l;dNTPs(10 mmol/L) 2.0 l;MgCl2(25 mmol/L) 2.0 l;10 mol/L上下游引物各0.2 l; 5 U/l的Taq DNA聚合酶(TaKaRa大连宝生物工程有限公司)0.8 l,总反应液为25 l。(3)PCR扩增反应参数:混合液先96℃预处理2 min(变性),然后进入双循环:第1循环96℃ 40 s,57℃ 40 s,72℃ 1 min×3;第2循环94℃ 40 s,57℃ 40 s,72℃ 1 min×29。双循环后72℃延伸7 min,然后4℃继续保温,扩增片段大小为2120 bp。PCR反应在9700型扩增仪(美国PE公司)上完成。(4)扩增产物酶切:用内切酶AvaⅡ酶切,酶切反应液包括21.5 l H2O;5.0l core buffer(×10),0.5 l牛血清白蛋白BSA(×100);1% PCR产物23.0 l;0.25 l AvaⅡ;37℃酶解3~4 h。(5)琼脂糖凝胶电泳与溴化乙锭(EB)染色:配制2%琼脂糖凝胶(琼脂糖2 g;0.5×硼酸(TBE)缓冲液100 ml;1~2滴溴化乙锭;微波炉中加热溶解),取2 l 2000 ladder作为片段长度标准,取2.0 l 的PCR产物作为未切对照,取PCR酶切产物各3 l加样,调20 mA电泳1 h。电泳完成后切断电源,取出凝胶,如果凝胶中加溴化乙锭,直接紫外灯下观察,否则将凝胶浸泡在0.5 mg/L的溴化乙锭缓冲液中30~45 min。然后在凝胶自动成像系统(美国Bio-Rad公司)中照相。(6)观察指标:根据观察片段分布及大小。按照文献[8]方法计算β-珠蛋白AvaII位点基因的观测杂合度(Hobs)、期望杂合度(Hexp)和多态信息含量(PIC);遗传标记的多态性程度及其应用价值采用杂合度(H)、个体识别力(DP)和非父排除率(EPP)来衡量[7]。其中基因杂合度能反映出群体的遗传变异水平。
1.2.4 β-链等位基因鉴定方法若DNA片断不包括AvaⅡ酶切位点,则PCR产物不能被切片,只出现2个片段(1116bp+1004bp),其等位基因为1(B1);若DNA片断包括AvaⅡ酶切位点,则PCR产物被切成3个片段(1116bp+790bp +214bp),其等位基因为2(B2);当2条染色体上等位基因均为1时,判定该个体基因型为B1/B1;当2条染色体上等位基因均为2时,判断该个体基因型为B2/B2;当2条染色体上等位基因分别为1/2时,判定该个体基因型为B1/B2。
1.3 统计分析采用SPSS 12.0软件进行分析。用x2检验对酶切的实际结果和理论值的一致符合率进行比较,以及进行哈代-范堡(Hardy-Weinberg)平衡分析和β-珠蛋白AvaII位点基因多态性的族间差异性比较。
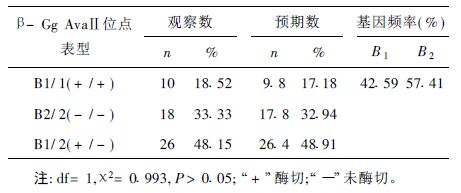
2 结果 2.1 多态性位点(图 1)图 1可见,β-珠蛋白AvaII在2120bp的PCR产物含有多态位点,血红蛋白β-链基因中该酶的识别位点有2个,即Y和X,识别位点序列为5'- GGA(T)CC-3',X位点具有多态性,Y位点没有多态性。2120 bp的扩增产物酶切后产生1116,790和214 bp等3个片段。其中,等位基因1(B1)无AvaⅡ位点,酶切后仍为2个片段1116 bp+1004 bp (图 1中1~3泳道);等位基因2(B2)含有 AvaⅡ位点,酶切后可产生1116 bp+790 bp +214 bp等3个片段(图 1中5,6泳道),而B1/B2杂合子酶切后可具1116 bp+1004 bp+790 bp +214 bp 共4条带(图 1中4,7,8泳道)。
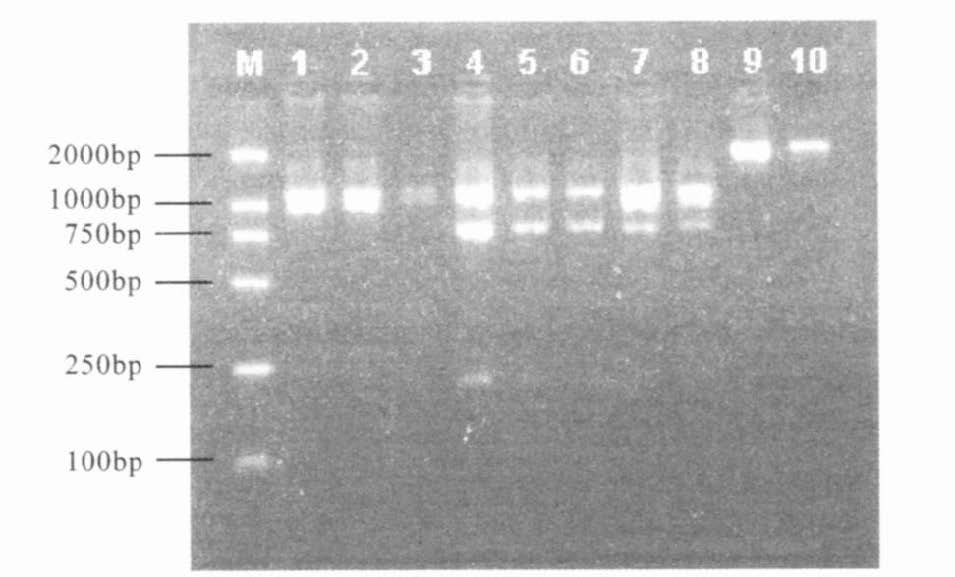
|
注:M is DNA Marker DL2000;1~3:未酶切产物B1/1(纯合子或-/-);5,6:酶切产物B2/2(纯合子或+/+);4,7,8:酶切产物B1/2(杂合子或+/-);9~10:PCR产物(未酶切对照)。 图 1 2120bp片断内的AvaⅡ位点的遗传多态性 |
2.2 基因型及等位基因频率分布(表 1)
54人108条染色体中,B1/B1基因型 10人,B2/B2基因型18人,B1/B2基因型26人。根据得出的克里雅人的遗传结构数据,计算的β-链多态性基因DP=0.7125;EPP=0.5641,H=0.5429。
| 表 1 β-链基因AvaⅡ酶切位点多态性的基因型和等位基因频率 |
2.3 平衡吻合度检验(表 1)
x2检验结果表明,克里雅正常人基因型计数的观察值和期望值吻合良好,符合哈代-范堡遗传平衡定律,也表明该群体β-链基因领域DNA多态性的检测结果具有代表性。
2.4 杂合度(H)、期望杂合度(h)多态信息量(PIC)根据Nei[5]公式计算得:杂合度(H)=0.4815,期望杂合度(h)=0.4891,H与h之间差异无统计学意义(x2=0.1213,P>0.05)。根据Batstein公式计算,多态信息量(PIC)=0.6735。
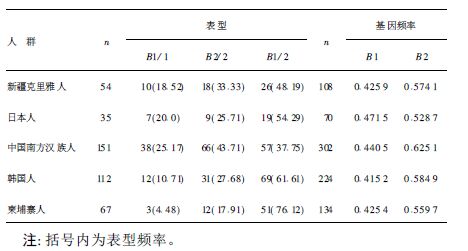
2.5 新疆克里雅人β珠蛋白基因领域多态性与其他人群比较(表 2)表 2可见,新疆克里雅人与柬埔寨人、韩国人、日本人群体一样,B1/2杂合子表型频率最高,B2/2纯合子频率次之,B1/1纯合子频率最低;中国南方汉族人B2/2纯合子表型频率最高,B1/2杂合子表型频率次之,B1/1纯合子频率最低。B1/2杂合子表型频率高到低依次为中国南方汉族人>新疆克里雅人>韩国人>日本人>柬埔寨人。
| 表 2 新疆克里雅人β-链基因领域AvaⅡ位点多态性与其他人群的比较 |
3 讨论
目前,全世界血红蛋白基因家族的点突变为基础的血红蛋白变异类型和基因融合约有696种。近年来,国内外学者对血红蛋白珠蛋白的基因结构及地中海贫血的基因缺陷等进行了研究,对不同地区和民族进行β-链基因领域多态性的研究,对减少重症地中海贫血婴儿的出生具有重要的意义[8-10]。 研究结果表明,β-珠蛋白基因家族各基因多态性只有在改变其所表达的蛋白质功能时才被认为是有效应的。β-珠蛋白基因领域有效应的基因多态性包括:(1)编码区基因的点突变,导致氨基酸的替换,从而改变蛋白质生理活性、稳定性;(2)复制或多重复制基因;(3)完全或部分基因丢失,导致缺乏基因产物;(4)剪切位点变异。在基因调节区的基因多态性也可以影响蛋白质的表达量,在其他非编码区的突变可以影响mRNA的稳定性或剪切功能。分子流行病学中的大多数遗传学研究都集中在β珠蛋白基因领域的这几种功能,这些研究也应用于群体调查、法医学个体识别及亲权鉴定等研究领域[11]。 本研究中,新疆封闭的克里雅正常人群中以B1/2型居多,而B2/2型次之,B1/1型最少。与国外某些人群间β-链AvaⅡ位点基因多态性相比,新疆克里雅正常人群的B2等位基因频率明显高于日本人和柬埔寨人,但又低于中国南方汉族人和韩国正常人群(P>0.05)。B1等位基因频率相近于柬埔寨人和韩国正常人群,但低于日本人和中国南方汉族正常人群。结果表明,β-链AvaⅡ位点的基因多态性分布在不同民族群体和区域间存在差异。此外,本研究得到了β-珠蛋白基因多态性在克里雅正常人群的分布情况,也为今后研究β-珠蛋白基因多态性与疾病间的相互关系提供了基础依据。
| [1] | 杜传书. 地中海贫血的研究现状[J][J]. 中华医学遗传学杂志, 1996, 13 : 257–258. |
| [2] | 周玉球, 徐湘民. 中国人β-地中海贫血分子基础和产前诊断[J][J]. 国外医学遗传学分册, 1995(3) : 132–137. |
| [3] | 丸林あずさ.PCR法にょるヒトβダロビン遗传子群 のハプロタイプの决定[D].鸣门教育大学修士论文,1999. |
| [4] | 时政コず 惠.アジア人集团におけるβダロビン遗传子群 ハプロタイプの 分析[D].鸣门教育大学修士论文,1998. |
| [5] | 桥本登代子.ヒトのβダロビン遗传子领域のDNA多型にょる集团间比较[D].鸣门教育大学修士论文,1996. |
| [6] | 郑秀芬. 法医DNA分析[M][M]. 北京: 中国人民公安大学出版社, 2002: 374-390. |
| [7] | Kolman CJ, Sambuughin N, Bermingham E. Mitochondrial DNA analysis of Mongolian populations and implications for the origin of new world founders[J][J]. Genetics, 1996, 142 : 1321–1324. |
| [8] | Herrmann M G, Dobrowolski S F, Wittwer C T. Rapid betaglobin genotyping by multiplexing probe melting temperature and color[J][J]. Clin Chem, 2000, 46(3) : 425–428. |
| [9] | Viprakasit V, Chinchang W, Suwanthol L. Common origin of a rara beta-globen initiation codon mutation (ATG-AGG) in Asians[J][J]. Clin Lab Haematol, 2005, 27(6) : 409–415. DOI:10.1111/clh.2005.27.issue-6 |
| [10] | Centis F, Tabellini L, Lucareclli G, et al. The importance of erythroid expansion in determining the extent of apoptosis in erythroidprecursors in atients with β-thalassemia major[J][J]. Blood, 1999, 98(1) : 123–126. |
| [11] | Kuypers FA, Yuan J, Lewis RA, et al. Membrane phospholipid a symmet ry in human thalassem ia[J][J]. Blood, 1998, 91(1) : 3044–3051. |
 2008, Vol. 24
2008, Vol. 24