2. 吉林省吉林市中心医院;
3. 吉林省吉林市卫生局卫生监督所
已有资料证实,病毒包膜脂类的存在与病毒的吸附和侵入有关[1, 2]。本研究前期观察结果表明,采用甲基-β-环糊精(MβCD)作用于人类疱疹病毒6型A(HHV-6A),可使包膜胆固醇含量明显下降[3]。为进一步探讨包膜胆固醇在病毒侵入宿主细胞过程中的作用,本文观察去除HHV-6A包膜胆固醇后,病毒与靶细胞结合、融合及进入靶细胞的状态,以及外源性补充胆固醇后HHV-6A感染力的变化。结果报告如下。
1 材料与方法 1.1 材料(1)病毒株与细胞株:HHV-6A GS株;易感的T细胞株HSB-2和Jurkat细胞株;脐带血单核细胞(CBMCs)(日本大阪大学医学部微生物室惠赠)。(2)试剂:细胞培养液10%小牛血清(FCS,美国Sigma公司);RPMI1640(自行配置);病毒包膜糖蛋白单克隆抗体(gQ,gL,gO等)及抗IE1单克隆抗体(日本大阪大学医学部细菌室);甲基-β-环糊精(MβCD)和二氢胆固醇(美国Sigma公司),蛋白免疫印迹试验(Western blotting,WB)试剂(日本TaKaRa公司)。(3)仪器设备:OptimaTMTLX超速离心机(美国BECKMAN公司);荧光显微镜(NIKONECLIPSEE 600,公司日本);X光片曝光成像系统(日本富士公司);CO2培养箱(日本SANYO公司)。
1.2 方法 1.2.1 感染细胞、病毒纯化及病毒包膜胆固醇去除HHV-6A感染HSB-2细胞、纯化病毒制备及病毒包膜胆固醇去除均按文献[3]进行。
1.2.2 不同处理条件对HHV-6A结合靶细胞的影响(1)将HSB-2细胞用磷酸盐缓冲液(PBS)洗2次,并保持在冰上30min;用10mmol/L的MβCD处理经蔗糖密度梯度纯化的HHV-6A病毒体,再用20%蔗糖溶液70000r/min离心2h去除MβCD并再纯化病毒,用RPMI1640液500l悬浮纯化的病毒体,然后将病毒体与HSB-2细胞混合,分为PBS,0,10mmol/L MβCD 3组,4℃培养60min,收获细胞备用;37℃培养40min感染细胞,继续培养18h,收获细胞备用。分别将上述4℃培养60min,37℃培养18h所收获的细胞洗涤2次,固定染色,用抗-gB单克隆抗体进行免疫荧光检测(IFA),比较不同条件下病毒与宿主细胞结合的程度;(2)取上述37℃培养18h病毒体感染的HSB-2细胞,用PBS洗涤细胞2次,超声波破碎细胞后,进行十二烷基磺酸钠(SDS)-聚丙烯酰胺凝胶电泳,转膜后用抗-即时早期蛋白(immediately early protein1,IE1)单克隆抗体做WB以检测IE1的表达。(3)将病毒体与HSB-2细胞混合后,细胞洗涤2次,用抗-gB和抗-gQ1单克隆抗体处理细胞,采用流式细胞仪检测病毒与细胞结合量的变化。(4)MβCD处理后病毒感染Jurkat细胞:取经MβCD去除胆固醇的HHV-6A,感染Jurkat细胞,感染后6h,取细胞进行免疫荧光(IFA)检查和倒置显微镜观察;感染后20h进行免疫印迹(WB)检测IE1的表达。
1.2.3 外源性胆固醇补充实验为检测MβCD去除胆固醇的作用是否不可逆,将HHV-6AGS用2.5mmol/L的MβCD,37℃作用1h之后,分别给予50,100,200mmol/L的外源性胆固醇即二氢胆固醇,再培养1h,将处理过的病毒经20%蔗糖溶液70000r/min离心2h,去除MβCD,用500l含10%FCS的RPMI 1640液重悬病毒并用0.22m的滤器过滤。然后感染细胞,分别检测病毒与细胞融合程度和IE1表达的恢复水平。
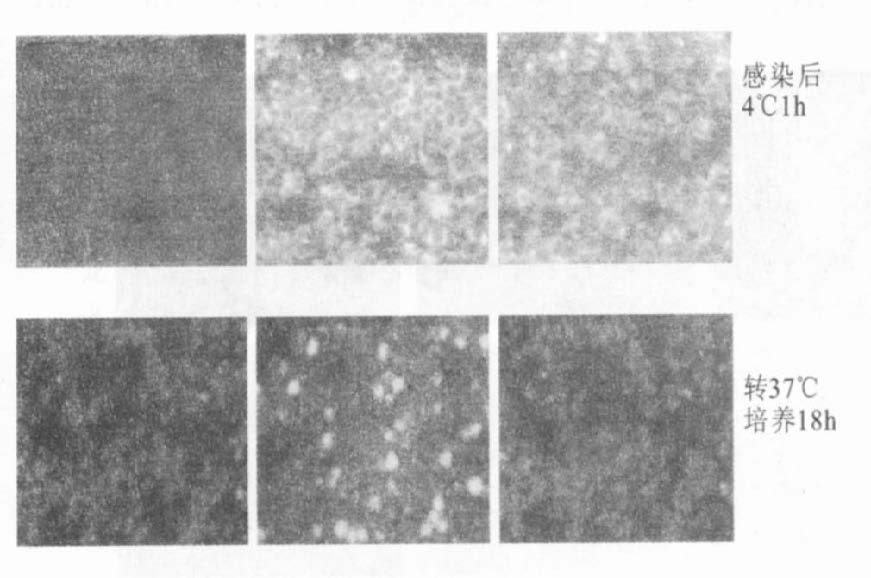
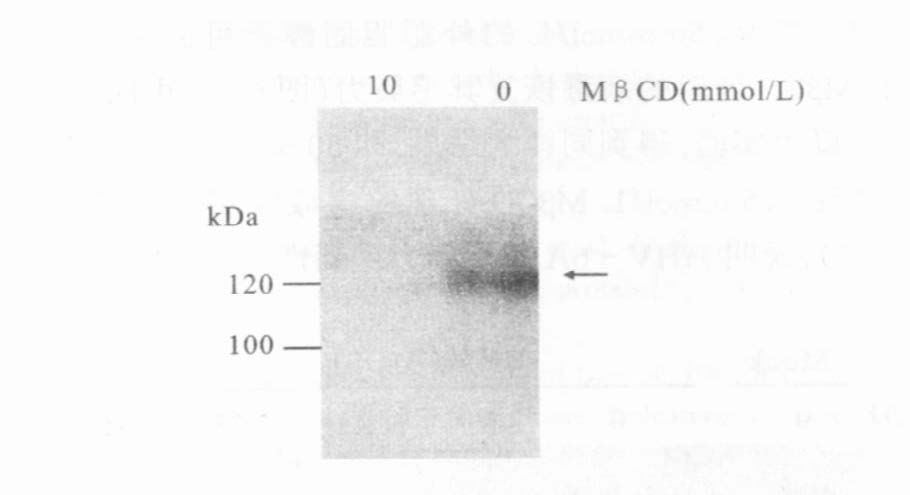
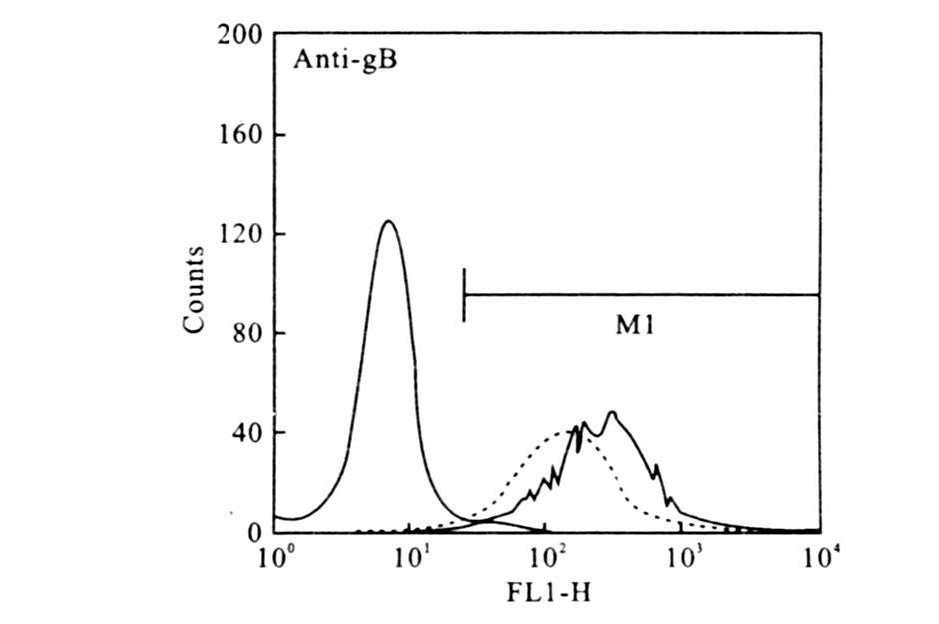
2 结果 2.1 不同处理条件对HHV-6A与靶细胞结合程度的影响(图 1~图 3)图 1可见,经和未经MβCD处理的病毒体尽管都能与细胞结合,但表现不同。经10mmol/L MβCD处理的病毒体与HSB-2细胞4℃培养60min后,IFA检查结果显示,与细胞结合的病毒体较未经MβCD处理的减少。转入37℃继续培养18h后的IFA结果显示,经10mmol/L MβCD处理的病毒感染细胞中未见有病毒蛋白gB的表达,表明没有病毒进入宿主细胞。图 2可见,用10mmol/L MβCD处理的病毒体未检测到IE1。图 3流式细胞仪检测结果表明,经MβCD处理过的病毒结合靶细胞的量减少。
|
图 1 用抗-gB单克隆抗体IFA检测HHV-6A吸附HSB-2细胞的比较 |
|
图 2 用抗-即时早期蛋白(抗-IE1)单克隆抗体WB检测病毒IE1的表达 |
|
注:— 未处理的病毒体;…… MβCD处理过的病毒体。 图 3 抗-gB单克隆抗体处理细胞后的流式细胞仪检测结果 |
2.2 不同浓度MβCD处理病毒感染Jurkat细胞的变化 2.2.1 融合程度变化(图 4)
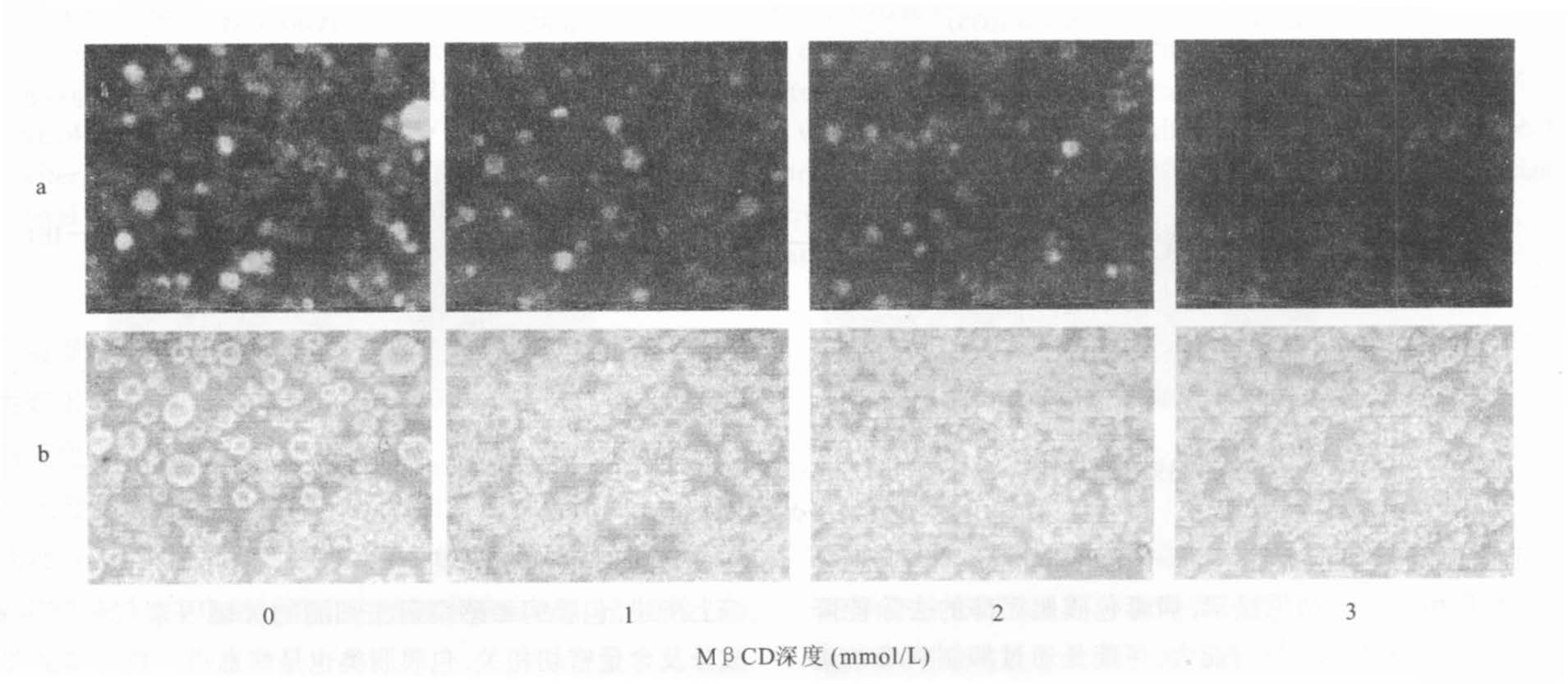
图 4可见,与未经MβCD处理的病毒体相比较,经不同浓度MβCD处理后的病毒体,在Jurkat细胞后,可减少感染细胞的融合,而且随着MβCD浓度的增加,融合细胞量显著减少(图 4a),倒置显微镜下也显示细胞与细胞融合形成大细胞的比例,随着MβCD浓度的增加而显著降低(图 4b)。
|
注:a:IFA检测结果;b:倒置显微镜检测结果。 图 4 不同浓度MβCD处理的HHV-6A感染Jurkat细胞融合程度变化 |
2.2.2 感染细胞IE1的表达(图 5)
图 5可见,2mmol/L的MβCD就可导致IE1的表达显著降低,3mmol/L MβCD处理的HHV-6,几乎检测不到IE1表达。
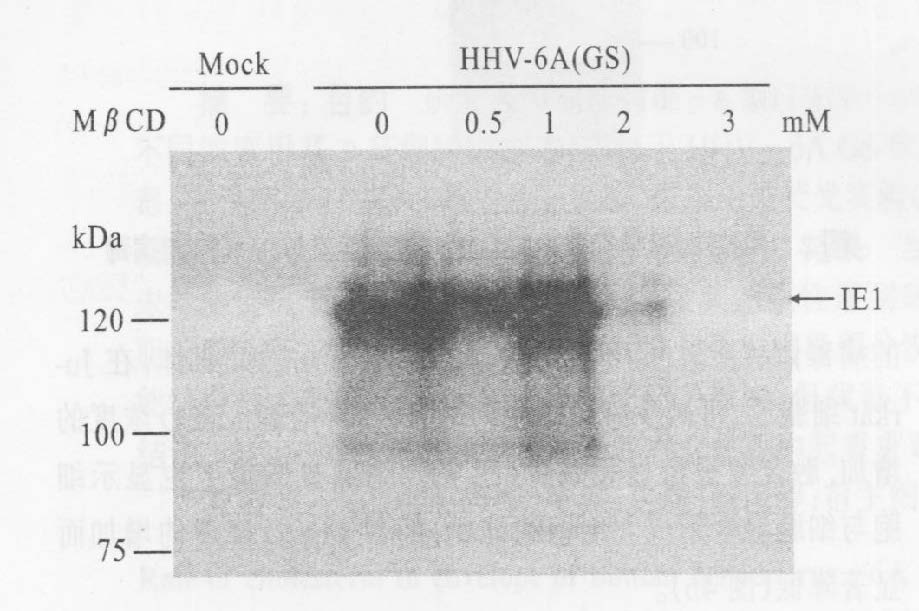
|
图 5 不同浓度MβCD处理HHV-6A感染Jurkat细胞20h后IE1表达水平 |
2.3 胆固醇补充实验
经MβCD处理的HHV-6A给予外源性二氢胆固醇后,HHV-6A诱导的细胞融合及IE1的表达均可得到恢复,50mmol/L的外源胆固醇就可以使经2.5mmol/L MβCD处理的病毒恢复其感染力(图 6)。用HSB-2细胞重复以上实验,得到同样的结果,即50mmol/L的胆固醇也可以使经2.5mmol/L MβCD处理的病毒恢复表达IE1的能力(图 7);表明HHV-6A的感染力得到恢复。
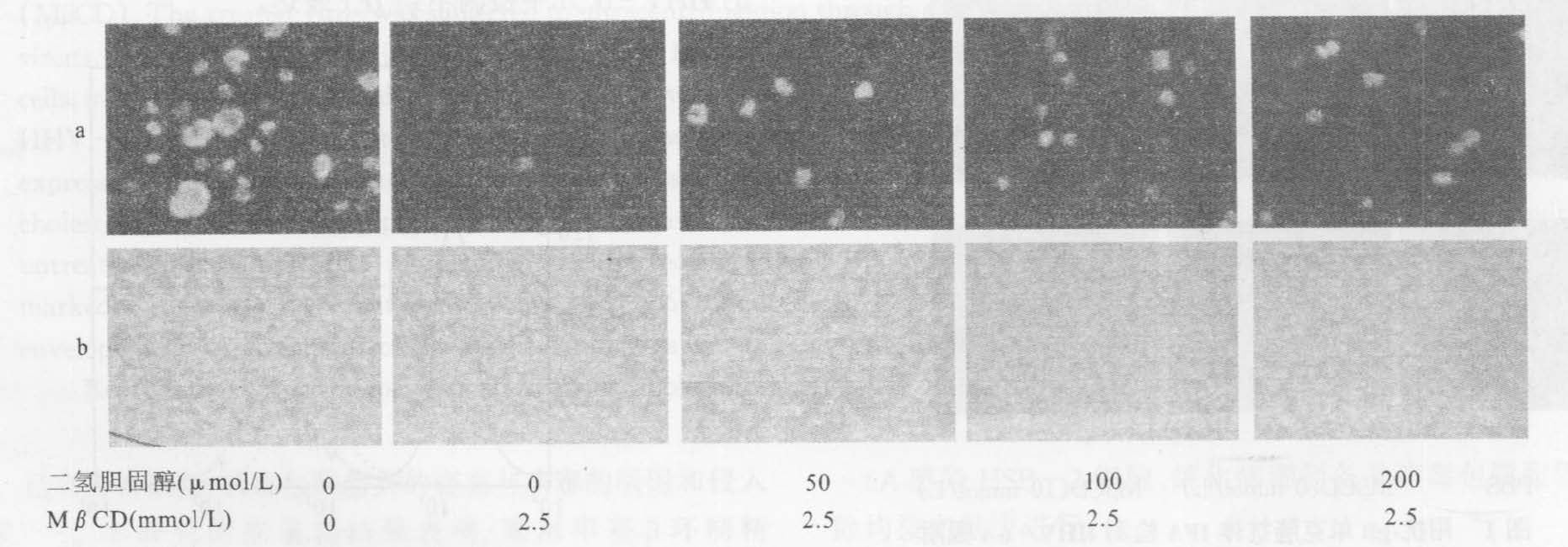
|
注:a:用抗-IE1单克隆抗体IFA检测结果; b:病毒感染后4h用倒置显微镜检测到的细胞融合情况。 图 6 不同浓度MβCD处理HHV-6A感染Jurkat细胞和补充外源性胆固醇后的细胞变化 |
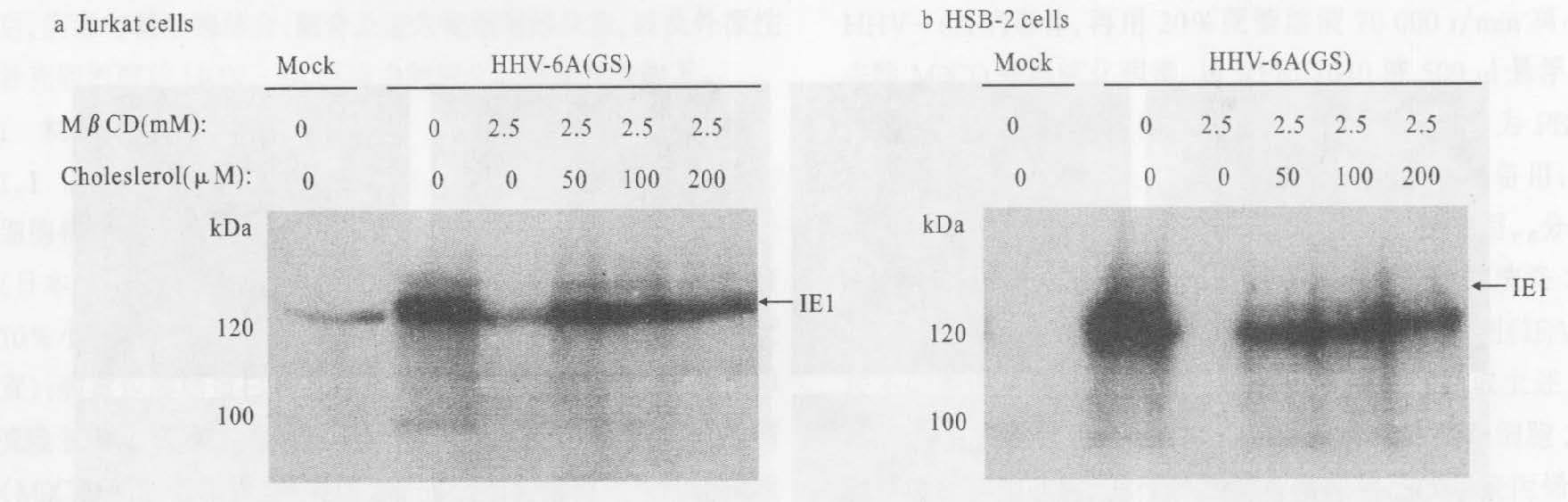
|
注:a:感染Jurkat细胞18h后的IE1表达; b:感染HSB-2细胞18h后的IE1表达。 图 7 抗-IE1 mAb Western blotting检测结果 |
3 讨论
研究表明,HHV-6A包膜糖蛋白复合体可与T细胞(HSB-2)CD46结合[4, 5],主要是HHV-6A包膜糖蛋白gH-gL-gQ1-gQ2(glycoprotein H-glycoprotein L-glycoprotein Q1-glycoproteinQ2)复合体作为配体与人类细胞CD46结合[6]。使其在进入宿主细胞前就能引起细胞融合而出现多核巨细胞。即时早期蛋白IE1是由HHV-6A U1102基因编码,含有941个氨基酸的蛋白质,是病毒进入细胞后最先表达的蛋白,一般在病毒感染后4h可以被检测到微量,大量被检测到是在感染后12h以后,此种蛋白质在病毒建立增殖性感染、复活潜伏性感染及逃避免疫识别中起着关键性作用[7, 8]。本文观察了去除HHV-6A包膜胆固醇和补充外源性胆固醇后,HHV-6A与靶细胞结合、融合以及进入靶细胞,病毒IE1表达的影响等变化。结果表明,通过使用膜胆固醇结合药物MβCD处理病毒后,HHV-6A病毒体虽仍然能与靶细胞结合,却不能进入靶细胞。10mmol/L MβCD即可完全抑制病毒IE1的表达及细胞与细胞的融合;补充外源性胆固醇后可部分恢复HHV-6A的感染性及细胞融合,表明HHV-6A包膜胆固醇如同其他有包膜病毒一样,对病毒诱导细胞融合起了重要作用[9, 10]。结果显示,病毒包膜胆固醇的去除能降低HHV-6感染宿主细胞的能力,可能是通过抑制病毒的进入而实现的。同时去除包膜胆固醇可以显著影响IE1表达及病毒诱导的细胞融合,其机制可能是由于胆固醇的缺如影响了病毒包膜-细胞膜,宿主细胞膜-细胞膜的融合而阻碍了病毒进入靶细胞,由于缺少胆固醇的包膜坚硬性降低,对糖蛋白的支撑作用松弛,松弛的包膜基底不能介导良好的融合而使病毒进入宿主细胞,甚至影响其与细胞的结合。
综上所述,包膜病毒感染宿主细胞的关键因素与包膜胆固醇成分及含量密切相关,包膜脂类也是病毒进入靶细胞的关键。
| [1] | Waarts B -L, Bittman, R Wilschut J. Sphingolipid and choles-terol dependence of alphavirus membrane fusion : lack of correla-tion with lipid raft formation in target liposomes[J]. J Biol Chem, 2002, 277(41) : 38141–38147. DOI:10.1074/jbc.M206998200 |
| [2] | Bender F C, Whitbeck J C, Ponce de Leon M, et al. Specific associ-ation of glycoprotein B with lipid rafts during herpes simplex virus entry[J]. J Virol, 2003, 77(17) : 9542–9552. DOI:10.1128/JVI.77.17.9542-9552.2003 |
| [3] | 李咏梅, 孙敏, 王大海. 人类疱疹病毒6型包膜胆固醇去除及糖蛋白的表达[J]. 中国公共卫生, 2008. |
| [4] | Santoro F, Kennedy P E, Locatelli G, et al. CD46 is a cellular re-ceptor for human herpesvirus 6[J]. Cell, 1999, 99(7) : 817–827. DOI:10.1016/S0092-8674(00)81678-5 |
| [5] | Mori Y, Seya T, Huang H L, et al. Human herpesvirus 6 variant A but not variant B induces fusion from without in a variety of hu-man cells through a human herpesvirus 6 entry receptor, CD46[J]. J Virol, 2002, 76(13) : 6750–6761. DOI:10.1128/JVI.76.13.6750-6761.2002 |
| [6] | Akkapaiboon P, Mori Y, Sadaoka T, et al. Intracellular processing of human herpesvirus 6 glycoproteins Q1 and Q2 into tetrameric complexes expressed on the viral envelope[J]. J Virol, 2004, 78(15) : 7969–7983. DOI:10.1128/JVI.78.15.7969-7983.2004 |
| [7] | Annie Grave, Jean Gosselin and Louis Flamand. Human her-pesvirus 6 immediate -early 1 protein is a sumoylated nuclear phosphoprotein colocalizing with promyelocytic leukemia protein -associated nuclear bodies[J]. J Biol Chem, 2002, 277(22) : 19679–19687. DOI:10.1074/jbc.M200836200 |
| [8] | Stanton R, Fox JD, Caswell R, et al. Analysis of the human her-pesvirus -6 immediate -early 1 protein[J]. J Gen Virol, 2002, 83(pt 11) : 2811–2820. |
| [9] | Guyader M, Kiyokawa E, Abrami L, et al. Role for human immun-odeficiency virus type 1 membrane cholesterol in viral internaliza-tion[J]. J Virol, 2002, 76(20) : 10356–10364. DOI:10.1128/JVI.76.20.10356-10364.2002 |
| [10] | Viard M, Parolini I, Sargiacomo M, et al. Role of cholesterol in hu-man immunodeficiency virus type 1 envelope protein -mediated fusion with host cells[J]. J Virol, 2002, 76(22) : 11584–11595. DOI:10.1128/JVI.76.22.11584-11595.2002 |
 2008, Vol. 24
2008, Vol. 24
