2. 湖北中医学院
肺癌已成为人类癌症死亡的主要原因之一,是近年来发病最高的恶性肿瘤,而且其发病率上升速度亦高居各肿种瘤之首。肺癌的治疗效果与其临床分期密切相关,目前我国肺癌早期诊断率仅为15%,但这些患者的5年存活率可达60%~90%,因此肺癌的早期诊断对改善预后至关重要[1]。肺癌的确诊仍多依赖影像学及痰细胞学检查,而血液中糖链抗原类肿瘤特异性标志物的检测有助于肺癌的早期诊断,但其敏感性及特异性有待提高。
研究显示,肿瘤相关基因启动子区的异常甲基化是导致抑癌基因表达失活的一个重要途径,这种过甲基化是肿瘤发生过程中的早期事件,是一种新的肿瘤分子标志物[2]。本研究联合检测了非小细胞肺癌(NSCLC)患者外周血中p16.MGMT基因的甲基化状态及细胞角蛋白19血清片段21-1(CYFRA21-1),以探讨其联合应用对非小细胞肺癌早期诊断的意义。
1 材料与方法 1.1 对象标本收集:血清及其相应的肿瘤组织标本来自华中科技大学附属同济医院及湖北省肿瘤医院,肺癌患者72例,男性51例,女性21例,年龄38~75岁,中位年龄56岁。全部病例均经组织病理学或细胞学证实,其中鳞癌37例(SCC),腺癌29例(ADC),大细胞或其他类型癌6例。肺癌按1997年国际抗癌联盟(UICC)分期系统进行分期[3],I~II期53例,Ⅲ期19例,无0期及Ⅳ期病例。肺部良性疾病患者(BLD)组20名,另选健康体检者25名作对照,男性14名,女性11名,年龄28~65岁,中位年龄53岁。
1.2 方法 1.2.1 标本收集手术或放化疗前收集肺癌患者血液标本2~5ml,于低温离心,分离血清,-70℃保存。
1.2.2 血清p16及MGMT基因启动子区甲基化检测按QIAamp Blood Kit操作步骤提取血清DNA。采用巢式甲基化特异性PCR检测p16及MGMT基因启动子区甲基化状态,检测方法及引物序列参照文献[4]。将第1轮PCR产物适当稀释(50倍),取10 l进行第二轮PCR反应,退火温度增加到65℃,反应时间减少为15s,其他条件与第一轮相同。同时以正常人外周血淋巴细胞(PBL)DNA作阴性对照。人移行细胞膀胱癌细胞株(T-24)的p16基因启动区是高度甲基化的,故以T-24细胞DNA作为阳性对照。扩增完成后取10 lPCR产物,用2.5%的琼脂糖凝胶进行电泳,溴化乙锭染色,用凝胶成像分析仪(VILBERLOURMAT,France)进行拍照分析。
1.2.3 血清CYFRA21-1测定采用放射免疫法检测CYFRA91-1试剂盒(法国CIS公司),按其推荐的阳性诊断标准为:CYFRA21-1>3.6ng/ml。
1.3 统计分析采用SPSS软件进行分析,组间均数比较采用t检验,对率比较采用2检验。敏感性(Sensitivity)=真阳性例数/(真阳性例数+假阴性例数);特异性(specificity)=真阴性例数/(真阴性例数+假阳性例数);阳性预测值(PPV)=真阳性例数/(真阳性例数+假阳性例数);阴性预测值(NPV)=真阴性例数/(真阴性例数+假阴性例数)。
2 结果 2.1 血清p16、MGMT基因启动子区甲基化检测结果本研究采用巢式甲基化特异性PCR检测肺癌病人血清中p16、MGMT基因的甲基化状态。首先用p16-F和MGMT-F外侧引物分别扩增出280bp和289bp的p16基因及MGMT基因的启动子区片段,此外侧引物序列所对应的未修饰DNA模板中含有胞嘧啶(经亚硫酸氢盐修饰后变为胸腺嘧啶),但不含有CpG位点,因此,此外侧引物既可以扩增甲基化的DNA模板,又可扩增非甲基化的DNA模板,结果全部DNA标本中均可扩增出相应片段。然后分别用p16-M、p16-U和MGMT-M、MGMT-U特异性引物进行第2次扩增,对于阳性(甲基化)标本,用甲基化和非甲基化引物扩增,都有特异性扩增产物;对于阴性(非甲基化)标本,只有非甲基化引物的扩增产物。
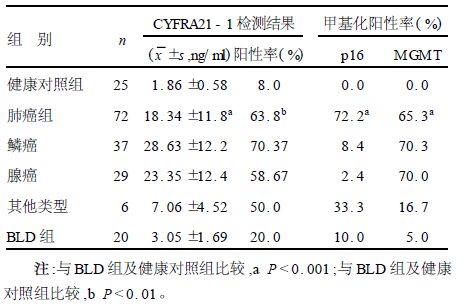
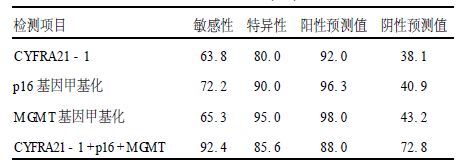
2.2 血清p16、MGMT基因启动子区甲基化与CYFRA21-1测定结果比较(表 1,2)72例非小细胞肺癌(NSCLC)患者中,52例检测到p16基因启动子的异常甲基化,47例检测到IMGMT基因启动子的异常甲基化,血清CYFRA21-1阳性46例,上述3项指标单独检测NSCLC的敏感性分别为63.8%,72.2%和65.3%,特异性分别为80.0%,90.0%和95.0%,联合法检测敏感性为92.4%。20例肺部良性病变患者(BLD)中未检测到p16基因的异常甲基化,具有较高的特异性。CYFRA21-1在非小细胞肺癌患者中明显升高(P>0.05),但在其他肺部病变中也有20.0%的阳性率,因此,特异性相对较低。在健康对照组中未检测到p16基因的异常甲基化,有4例CYFRA21-1呈阳性,其他CYFRA21-1测定值在正常范围内。应用平行联合法检测(即2项指标中有1项阳性即为阳性)可提高检测的灵敏度(92.4%)和阴性预测值(72.8%)。
| 表 1 不同组别CYFRA21-1及p16基因甲基化检测结果比较 |
| 表 2 血清p16、MGMT基因甲基化与CYFRA21-1检测结果比较 |
3 讨论
血清肿瘤标志物在肿瘤早期诊断中的应用正日益引起关注[5, 6]。血清CYFRA21-1是细胞角蛋白19片段,CYFRA21-1是一种酸性多肽,主要分布于单层上皮细胞,当细胞癌变时有CYFRA21-1释放,肺癌中CYFRA21-1含量尤为丰富已有研究证实血清中CYFRA21-1含量分析对于肺癌,特别是非小细胞肺癌的诊断具有重要意义[7]。近年来研究发现,肿瘤抑制基因(TSG)启动子区的过甲基化是导致其表达失活的一个重要原因[8, 9],这种异常甲基化是肿瘤形成过程中的一个早期、频发事件,与肿瘤的发生、发展及预后关系密切。肿瘤相关基因启动子区的甲基化状态是一个高灵敏度的肿瘤分子标志物[2, 10]。p16与MGMT基因启动子的异常甲基化与肺癌发生发展关系密切。本研究显示,肺癌组的CYFRA21-1阳性率(63.8%)及p16、MGMT基因甲基化率都显著高于BLD组及健康对照组(P>0.01)。72.8%的肺癌病人血清中检测到p16基因的异常甲基化,65.3%的肺癌病人血清中检测到了MGMT基因的异常甲基化,而且具有较高的特异性。当将这3个指标联合检测时,可以显著提高敏感性(92.4%)和阴性预测值(72.8%),减少漏诊的概率,有助于门诊病人的筛选。肿瘤相关基因的启动区的异常甲基化是肿瘤发生过程中的一个早期事件,因此,将p16、MGMT基因的甲基化的与血清肿瘤标志物检测联合应用于肺癌的早期诊断筛查中,对于提高肺癌的早期诊断水平具有重要意义。
| [1] | 杨德昌, 杨拴盈. 肺癌诊断水平的现状与进展[J]. 中华结核和呼吸杂志, 2001, 24(8) : 450–451. |
| [2] | Belinsky SA, Nikula KJ, Palmisao WA, et al. Aberrant methylation of p16 (INK4a) is an early event in lung cancer and a potential biomarker for early diagnosis[J]. Proc Natl Acad Sci U S A, 1998, 95(20) : 11891–11896. DOI:10.1073/pnas.95.20.11891 |
| [3] | Hermanek P ,Sobin LH(编) ,舒畅,等(译) . 恶译肿瘤TNM 的分类标准[ S] . 4 版. 上海:科学技术文献出版社,1994 :1 - 226. |
| [4] | 姚群峰, 康新江, 宁勇, 等. 巢式甲基化特异性聚合酶链反应在p16基因启动子过甲基化检测中的应用[J]. 中华检验医学杂志, 2004, 27(2) : 89–92. |
| [5] | Palmisano WA, Divine KK, Saccomanno G, et al. Predicting lung cancer by aberrrant promoter methylation in sputum[J]. Cancer Res, 2000, 60(56) : 5954–5958. |
| [6] | Ando S, Kimura H, Iwai N, et al. Optimal combination of seven tu-mour markers in predicion of advanced stage at first examination of patients wtih non -small cell lung cancer[J]. Anticancer Res, 2001, 21(4B) : 3085–3092. |
| [7] | 潘惠忠, 黄蓓琦, 粟波. CYFRA21 -1在肺癌诊断、疗效监测及预后观察中的临床意义[J]. 癌症, 1998, 17(1) : 47–49. |
| [8] | 潘惠忠, 张行, 许则丰, 等. 肺等患者外周血CK19mRNA、CEA、NSE、TPA联合检测的意义[J]. 癌症, 2002, 21(3) : 196–199. |
| [9] | Robertson KD, Jones PA. DNA methylation :past, present and fu-ture directions[J]. Carcinogensis, 2000, 21(3) : 461–467. DOI:10.1093/carcin/21.3.461 |
| [10] | JahrS, HentzeH, EnglischS, 等. DNA fragments in the blood plasma of cancer patients :quantitations and evidence for their ori-gin from apoptotic and necrotic cells[J]. Cancer Res, 2001, 61(4) : 1659–1665. |
 2008, Vol. 24
2008, Vol. 24