志贺菌引起的细菌性痢疾发病率居我国传染病发病率的前3位。近年来,随着抗生素的广泛使用甚至滥用,造成志贺菌频繁发生变异产生耐药株,不断给细菌性痢疾的防治带来新的挑战。1996年,痢疾志贺菌被WHO认定为给人类带来巨大威胁的耐药性菌株。因此,探讨志贺菌耐多药的机制成为目前解决志贺菌耐多药的先决条件。本课题选取对抗生素敏感的1株志贺菌为受体菌,以1株耐多药大肠埃希菌为供体菌,以接合转移方式构建出耐多药菌株,通过比较敏感株与基因转移耐多药株蛋白质双向电泳图谱,研究志贺菌耐多药相关蛋白,并对表达差异蛋白进行基质辅助激光解析飞行时间质谱(MOLDI TOF-TOF)分析和数据库检索,旨在探索其耐多药机制。
1 材料与方法 1.1 材料 1.1.1 菌株(1)福氏痢疾杆菌标准株:菌株号51571-9(中国药品生物制品检定所);(2)敏感株及耐多药大肠埃希菌;采用改良K-B纸片法,从临床分离鉴定的志贺菌株中,筛选1株对头孢噻吩(CF)、诺氟沙星(NOR)、庆大霉素(GM)、磺胺甲基异恶唑(SMZ)均敏感的福氏志贺菌作为敏感株;对以上4种抗生素均耐药的致病性大肠埃希菌为接合基因转移实验的供体菌。
1.1.2 试剂与仪器头孢噻吩等抗生素均为标准品(中国药品检验中心)。固相pH梯度干胶条(immobiline pH gradient pH3~10,L=24 cm);固相pH梯度(IPG)缓冲液、IPG覆盖液、两性电解质(pharmalyte;pH3~10)、3-[3-胆酰胺丙基)-乙二胺]-1-丙磺酸(CHAPS)(美国Amersham Pharmacia公司)。丙烯酰胺、尿素(urea)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、蛋白酶抑制剂丙甲基磺酰氟(PMSF)、亮抑蛋白酶肽(leupeptin)(美国Sigma公司)。固相pH梯度等电聚集仪IPGphor IEF System,垂直板电泳仪、ImageScanner光密度扫描仪、图像分析系统(美国Amersham Pharmacia公司)。
1.2 方法 1.2.1 志贺菌敏感株与耐多药大肠埃希菌接合转移实验参照文献[1]进行。经此实验,将获得1株志贺菌基因转移耐多药株。用标准株作对照。
1.2.2 蛋白质双向电泳(1)蛋白提取方法:采用超声兼Urea-CHAPS-DTT-SB3-10裂解提取法[2],略作改进。(2)可溶性总蛋白定量:应用BradFord法[3]对提取的可溶性总蛋白进行定量;(3)第一相固相pH梯度等电聚焦:按文献[4]。程序分别为30 V 7 h,60 V 7 h,150 V 0.5 h,300 V 1 h,600 V 1 h,8 000 V 12 h。(4)平衡:按文献[3]。(5)第二相垂直板聚丙烯酰胺凝胶(SDS-PAGE)电泳:按文献[3]。(6)染色:银染按Amersham Bioscience的银染方案稍作改进[4]。考马斯亮蓝染色按Neuhoff等方法进行[5]。(7)图像扫描分析:用Amersham Bioscience的扫描仪投射扫描,分辨率为300 dpi。数字化图像文件运用Image Master 2D Platinum软件分析。图像分析过程包括蛋白质班点的检测、量化、背景扣除、匹配。蛋白质班点经自动检测后进行手工校对,匹配之前选取1块胶作为参考凝胶,其他凝胶都与之匹配。
1.2.3 质谱分析(1)质谱样品制备:比较双向电泳图谱,找到差异蛋白,切下1 mm3,置于1.5 ml的Eppendorf管中,按文献[6]方法处理样品。(2)质谱鉴定:样品按照1∶1的比例,与含有-氰基-羟基苯丙烯酸的50%乙腈/0.1%甲酸的溶液混合。所有质谱在4700型MALDT TOF-TOF蛋白质分析系统下获得。选择反射式阳离子捕获方式,质量精确度为50 mg/L;质谱(MS)光谱质量范围800~4 000 Da。
1.2.4 数据库检索(1)光谱分析:采用Mascot(http:∥prospector.ucsf.edu)和Profound(http:∥129.85.19.192/profound-bin/WebProFound.exe)软件进行处理和分析;搜索在美国国立生物技术信息中心(NCBInr)蛋白数据库进行;(2)搜索参数设置:相对分子质量误差范围±20%,肽片段相对分子质量误差范围±0.5 Da,每个肽允许有1个不完全裂解位点,物种选择细菌;(3)蛋白质身份确定:根据搜索结果并结合蛋白质在凝胶上的等电点和相对分子质量进行最终确定:要求肽段覆盖率>15%,匹配肽段至少4个,等电点和相对分子质量与观察值基本相符。
2 结果 2.1 接合转移耐多药基因结果志贺菌敏感株的最低抑菌浓度(MIC分别为头孢噻吩32 g/ml,诺氟沙星0.5 g/ml,庆大霉素2 g/ml,磺胺甲基异恶唑512 g/ml。与耐多药大肠埃希菌进行接合转移后,获得最低抑菌浓度分别为敏感株8倍和10倍的基因转移耐多药志贺菌。将基因转移耐多药志贺菌作药敏试验,结果4种抗生素抑菌环直径均为0 cm。
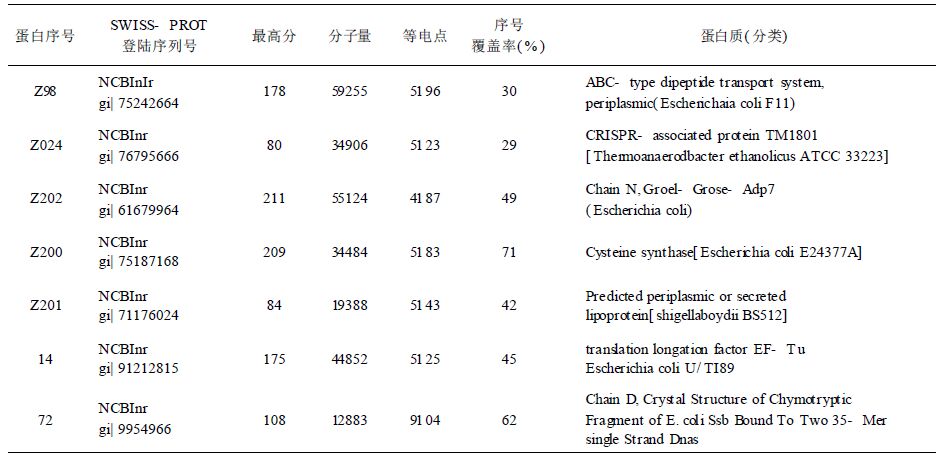
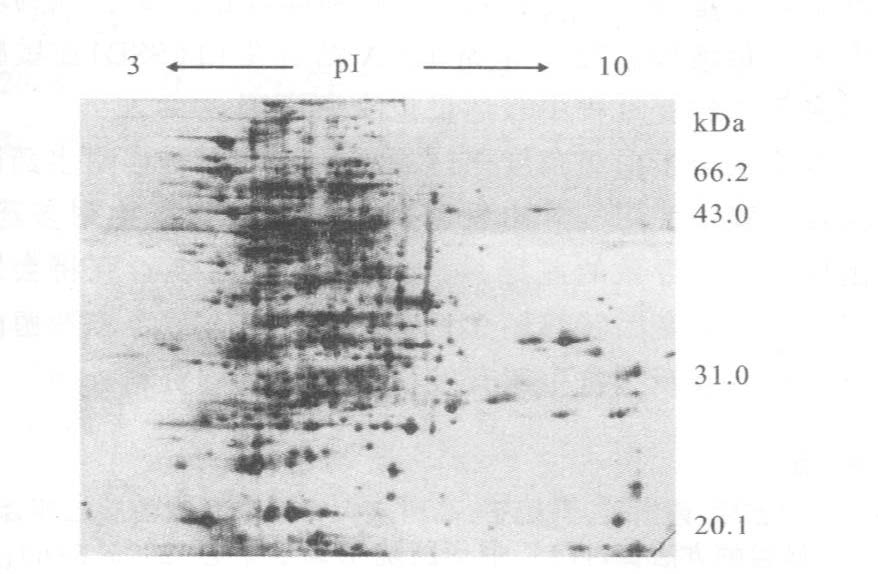
2.2 蛋白质双向电泳图谱比较相同实验条件及参数设置情况下,对志贺菌可溶性总蛋白重复3次进行双向电泳分离。结果显示,敏感株3次双向电泳图谱非常相似,蛋白质上样量为10 g,pH3~10;24 cm线性干胶条通过Image Master 2D Platinum分析软件进行点检测,获得(946±37)个蛋白质斑点(图 1)。志贺菌基因转移耐多药株获得3块凝胶的平均蛋白质点数为(1013±157)个(图 2)。经过背景消减,将其中1块胶作为参考凝胶进行匹配,匹配点数(998±24)个,匹配率98.52%。
|
注:蛋白质上样量100 μg;第一向pI3-10,24 cm线性干胶条;第二向应用12.5%聚丙烯酰胺凝胶(银染)。 图 1 志贺菌敏感株蛋白质双向电泳图谱 |
|
注:蛋白质上样量100 μg;第一向pI3-10,24 cm线性干胶条;第二向应用12.5%聚丙烯酰胺凝胶(银染)。 图 2 志贺菌基因转移耐多药株蛋白质双向电泳图谱 |
2.3 蛋白质差异表达谱
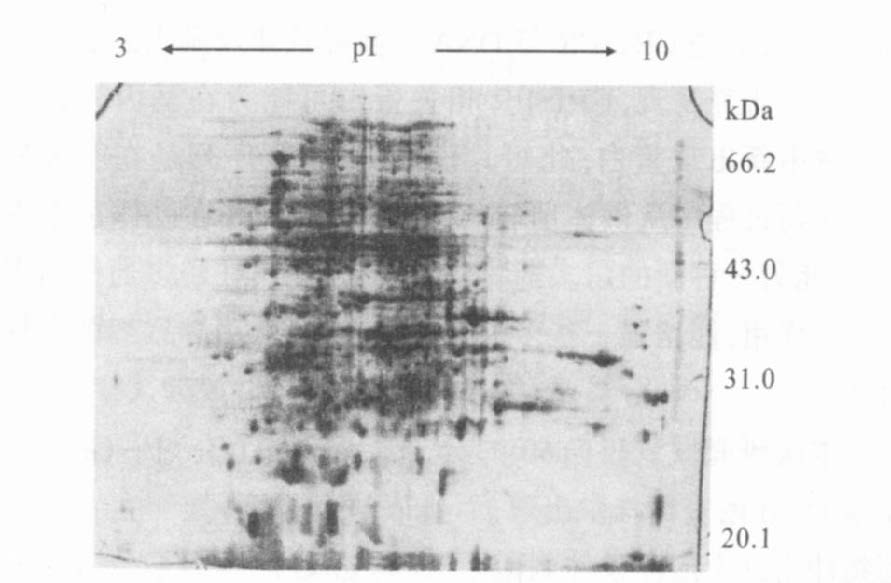
以基因转移耐多药株为参考凝胶,与敏感株进行双向凝胶图谱匹配,共发现43个差异表达的蛋白点,其中8个蛋白点只存在于基因转移耐多药株中,6个蛋白点只存在于敏感株中,还有29个蛋白点在2株菌株中表达量相差5倍以上,其中22个蛋白点随着志贺菌由敏感株向耐多药株转变而表量增加,7个蛋白点表达量下降(图 3,图 4)。
|
注:Z202号蛋白只存在于基因转移耐多药株。 图 3 只存在于基因转移株中蛋白质点 |
|
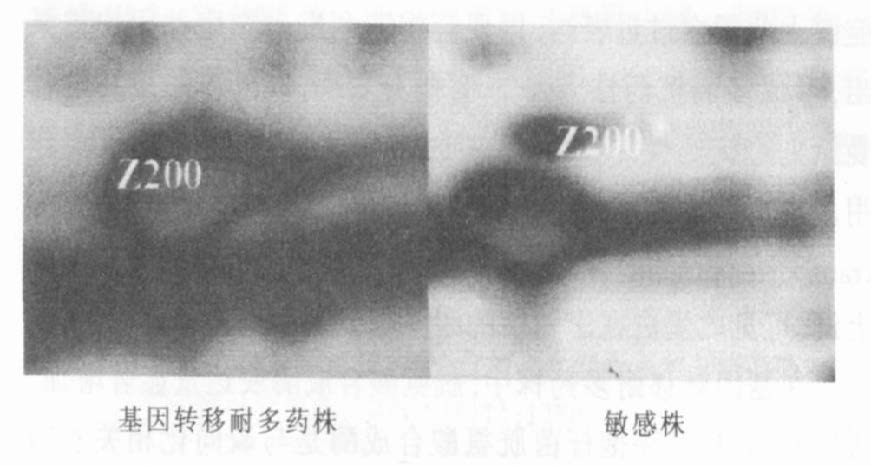
注:Z200号蛋白在基因转移耐多药中表达量增加。 图 4 表达量有差别的蛋白质点 |
2.4 质谱鉴定(表 1)
在考马斯亮蓝染色凝胶上选取7个在基因转移耐多药株表达量增加的差异点进行肽指纹图谱鉴定,其中Z202、Z204为新出现蛋白,Z200、Z201、Z98号点表达量增加,72,14号表达量下降。
| 表 1 志贺菌基因转移耐多药株表达量上调蛋白质谱鉴定结果 |
3 讨论
Jansen R等[7]发现,一个新的主要在原核细胞中出现的规律的成簇插入的DNA重复序列(CRISPR),片段大小约为21~37 bp,此可移动重复序列存在于半数以上的原核生物基因组中[8],这些CRISPR与DNA的新陈代谢及基因的表达有关[9]。本研究发现,CRISPR相关蛋白可能为在基因转移耐多药株中新出现蛋白,此短片段DNA重复序列是在基因转移耐多药过程中从供体菌转移入受体菌中,并在受体菌中表达,可能为一种新的耐多药相关蛋白,推测其在耐多药机制中起调节作用,能增强一些多药基因的表达,从而导致细菌出现耐多药。
本次研究发现,Hsp60的分子伴侣蛋白(Groel-Groes-Adp7)仅在耐多药株中出现,而且表达量很高,推测在大剂量药物冲击这个应激条件刺激下,编码groel的基因整合入志贺菌敏感株基因组中,并在新宿主菌中大量表达,防止新生的耐多药相关蛋白质发生聚集或折叠,保证它们的正确构象并增强它们的活性,籍此适应新的宿主环境。
ABC外排系统为细菌耐多药主动流出机制之一,肿瘤细胞膜上此蛋白过量表达,以便药物顺利进入细胞并很快被泵出,形成多药抗药性[10, 11]。有研究表明,此外排系统在利什曼原虫的抗药性中[12]及真菌的多药耐受性中[13]起重要作用。本文结果显示,98号ABC转运蛋白(ATP binding cassette transporter protein)在志贺菌基因转移耐多药株中表达量明显上调,可见此蛋白在志贺菌的耐多药机制中也起重要作用。
在基因转移耐多药株中,胱氨酸合成酶表达量显著增加。研究表明,枯草芽孢杆菌胱氨酸合成酶是与硫同化相关基因表达的一个通用负调控子[14],但此酶在志贺菌耐多药中的作用机制尚不清楚,推测此酶在耐多药机制中起着调控子的作用。质谱分析结果表明,一种分子量为19 388Da预测的胞质蛋白在基因转移株表达量显著增加,可能与药物的转运及耐多药信号的传导有关,但其与耐多药相关功能尚需进一步作N端或C端测序。本次结果表明,14号EF-Tu在志贺菌敏感株中表达量高。研究表明[15],此翻译延长因子在大肠埃希菌中表达量增加。72号单链DNA结合蛋白(SSB)在敏感株向耐多药株转变过程中表达量也有所下降。
本文从全蛋白组角度探讨志贺菌的基因转移耐多药机制并且在实验中使用一株出发菌通过基因转移产生耐多药,排除菌株不同而导致的差异,可比性较高。后续研究将会发现更多与志贺菌基因转移耐多药相关蛋白,从而为志贺菌耐多药分子机制及新型抗生素开发研制提供基础资料。
| [1] | 刘志远, 许淑珍, 马纪平. 高耐庆大霉素粪肠球菌质粒接合转移试验的方法探讨[J]. 中华医院感染学杂志, 2005, 5(6) : 12–14. |
| [2] | 贾继辉, 于修平, 郭辉玉, 等. 幽门螺杆菌蛋白质组双向电泳图谱的构建及其相关技术体系的建立[J]. 山东大学学报:医学版, 2003, 41(3) : 225–227. |
| [3] | Marshak DR, Kadonaga j T, Burgess RR, et al. 蛋白质纯化与鉴定实验指南[M].北京: 科学出版社, 2000: 158-159. |
| [4] | Berkelman T, St enst edt T. 2-D elect rophoresis using immobilized pH gradient s: principles & Methods[M].1998: 14-25. |
| [5] | Neuhoff V, Arold N, Taube D, et al. Improved staining of prot eins in polyacrylamide gels including isoelectric focusing gels with clear backgroun d at nanogram sensit ivity using Coomassie Brilliant Blue G-250 and R-250[J]. Elect rophoresis, 1998, 9(6) : 255–262. |
| [6] | Shevchenko A, Wilm M, Vorm O, et al. Mass s pect romet ric se-quencing of proteins Sil -st ained polyacrylamide gels[J]. Anal Chem, 1996, 68(5) : 850–858. DOI:10.1021/ac950914h |
| [7] | Jansen R, Embden JD, Gaastra W. Ident ificat ion of genes that are associat ed with DNA repeat s in prokaryot es[J]. Mol Microbiol, 2002, 43(6) : 1565–1575. DOI:10.1046/j.1365-2958.2002.02839.x |
| [8] | Nelson KE, Clayton RA, Gill SR, et al. E vidence for lat eral gen et ransfer between Archaea and bacteria from genome sequence of T hermotoga marit ima[J]. Nature, 1999, 399(6734) : 323–329. DOI:10.1038/20601 |
| [9] | Haft DH, Sel engut J, Mongodin EF, et al. A guild of 45 CRISPR -associated (Cas) prot ein families and multiple CRISPR/ Cas sub-types ex ist in prokaryot ic genomes[J]. PLoS Comput Biol, 2005, 1(6) : 0474–0483. |
| [10] | Johnstone RW, Ruefli AA, Smyth MJ. Mult iple physiological func-t ions for mult idrug t ransport er P -glycoprot ein[J]. Trends Biochem Sci, 2000, 25(1) : 1–6. DOI:10.1016/S0968-0004(99)01493-0 |
| [11] | Kim RB. Transport ers and xenobiot ic disposit ion[J]. T oxicology, 2002, 181-182 : 291–297. |
| [12] | Loiseau PM, Bories C. Mechan isms of drug action and drug resis-t ance in leishmania as basis for therapeut ic t arget ident ification and design of antileishmanial modulators[J]. Curr top Med Chem, 2006, 6(5) : 539–550. DOI:10.2174/156802606776743165 |
| [13] | Sipos G, Kuchler K. Fungal AT P-binding cassett e (ABC) t rans-port ers in drug resistance & detoxificat ion[J]. Curr Drug Tar-gets, 2006, 7(4) : 471–481. DOI:10.2174/138945006776359403 |
| [14] | Albanesi D, MansillaMC, Schujman GE, et al. Bacillus subt ilis cys-teine synthet ase is a global regulator of the expression of genes in-volved in sulfur assimilation[J]. J Bact eriol, 2005, 187(22) : 7631–7638. |
| [15] | Nguyen LD, Holub M, Kalachova L, et al. Post -t ranslat ional modificat ion (s) and cell dist ribut ion of st reptomyces aureofaciens t ranslat ion elongat ion factor Tu overproduced in Escheri chi a coli[J]. Folia Microbiol (Praha), 2005, 50(5) : 393–400. DOI:10.1007/BF02931420 |
 2008, Vol. 24
2008, Vol. 24