2. 南昌大学生命科学与食品工程学院
内皮素-1(endothelin-1,ET-1)是目前己知作用最强、最持久的内源性缩血管活性多肽,它与内皮素A型受体(endothelin A receptor,ETAR)结合产生极强的收缩血管和支气管作用[1]。生理状态下,ET-1通过收缩血管、调节肾小管分泌排泄和肾小球超滤过系数(Kf),与其他肾脏调节因素一起维持肾功能。这种调节机制一旦紊乱,ET-1便作为一种致病因子引发或参与肾脏病理生理过程[2]。芥子气中毒可造成包括肾脏在内的多器官损伤,且肾脏芥子气含量较高。本文旨在探讨ET-1和ETAR在芥子气中毒引起肾功能损伤中的作用。
1 材料与方法 1.1 材料雄性SD大鼠,体质量200~300g(中国科学院上海实验动物中心);芥子气(第二军医大学海医系防化医学教研室);S-P试剂盒(福州迈新生物技术开发公司);内皮素抗体(美国Oncogene公司);柱离心式组织总RNA抽提试剂盒(上海华舜生物工程有限公司);逆转录试剂盒(上海申能******公司);随机引物Oligo(dT)18(上海生工生物工程公司);特异引物依据文献[3]序列,由上海生工生物工程公司合成,preproET-1(正义链):5'-TCTTCTCTCTGCTGTTTGTG-3',preproET-1(反义链):5'-TAGTTTTCTTCCCTCCACC-3',扩增产物大小为482 bp;ETAR(正义链):5'-ATCGCTGACAATGCTGAGAG-3',ETAR(反义链):5'-CCACGATGAAAATGGTACAG-3',扩增产物大小为226 bp;GAPDH(正义链):5'-GCCATCAACGACCCCTTCATTG-3',GAPDH(反义链):5'-TGCCAGTGAGCTTCCCGTTC-3',扩增产物大小为592 bp。
1.2 动物分组及染毒大鼠随机分为正常组和中毒组,中毒组分中毒后2,6,12,24h 4个时相点(n=10)。芥子气纯度用冰点法测定为97%,相对密度1.27,临用前丙二醇稀释成0.2%(w/v)溶液,中毒组背部皮下注射芥予气[5mg/(kgbw) )半数致死量(LD50)],对照组注射等量丙二醇。
1.3 ET-1含量免疫组化分析断头处死大鼠,摘取肾脏,甲醛固定,制作石蜡切片,苏木素-伊红(H-E)染色,观察肾脏光镜下病变;并用链霉菌亲生物素蛋白-过氧化物酶免疫组化染色法(S-P方法)进行免疫组化染色,操作按试剂盒说明书,结合图像分析肾组织ET-1含量。从每张肾脏免疫组化切片随机选取5个视野,用Smart Scape 2002图像分析系统测量其平均吸光度(A)值(积分值),以此表示肾组织ET-l含量。
1.4 ET-1 mRNA及ETAR mRNA表达水平测定采用柱离心式组织总RNA抽提试剂盒提取总RNA,用紫外分光光度计测定RNA的浓度和纯度,要求所用RNA的A260/A280在1.8~2.0之间。采用RT-PCR法测定前原内皮素(preproET-1)、ETAR及3-磷酸甘油醛脱氢酶(GAPDH)的mRNA表达。取2g总RNA采用逆转录试剂盒,以Oligo(dT)18为引物合成cDNA,反应总体积为20l。PCR反应采用PCR扩增反应试剂盒,扩增反应引物为合成的特异引物,取每份标本的逆转录产物3l分别进行GAPDH、preproET-1、ETAR的cDNA扩增,扩增条件参照文献[3]。进行94℃ 15s,退火15s,72℃45s的热循环,GAPDH退火温度为62℃,32个热循环;prepro ET-1退火温度为54℃,38个热循环;ETAR退火温度为58℃,35个热循坏。扩增产物经1.5%琼脂糖凝胶电泳后拍照,然后进行吸光度扫描,并以GAPDH校正作相对量分析,数据以吸光度的比值表示。
1.5 统计分析采用SPSS 12.0软件进行统计分析,组间比较采用方差分析。
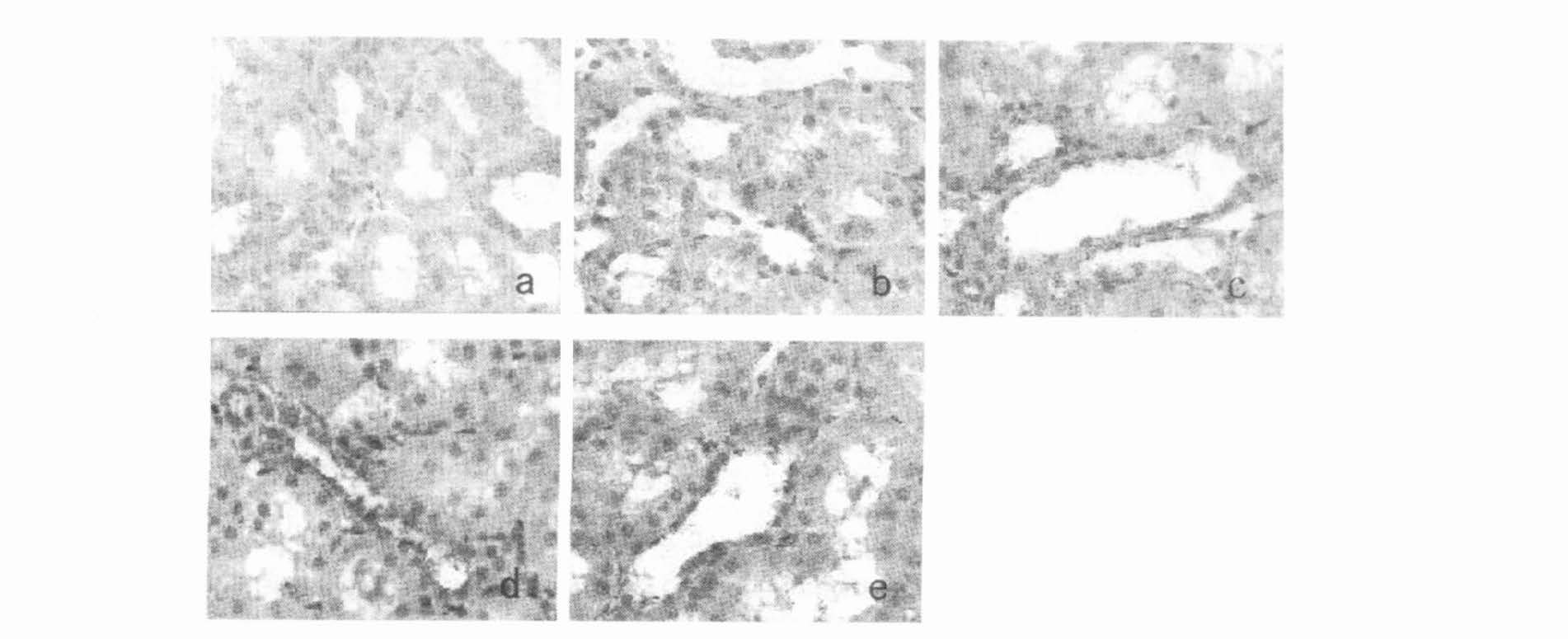
2 结果 2.1 ET-1含量的变化(图 1)光镜下观察,大鼠芥子气中毒后肾血管充血、水肿,肾实质细胞水样变性,肾小管上皮细胞变性坏死、脱落,基底膜裸露。远曲小管上皮ET-1呈阳性反应,上皮细胞胞浆内可见多量密集分布的深棕色颗粒,而近曲小管和集合管上皮细胞胞浆呈阴性反应。用图像分析系统测量结果表明,对照组吸光度值为273±78;中毒组染毒2h后吸光度值升至341±86,与对照组比较,差异有统计学意义(P<0.05),表明肾组织ET-1浓度明显升高;6h后达峰值,吸光度值为719±128;24h后虽有所回落,吸光度值降至378±88,但与对照组比较差异仍有统计学意义(P<0.01)。
|
注:a:对照组;b:染毒后2h;c:染毒后6h;d:染毒后12h;e:染毒后24h。 图 1 免疫组化分析肾脏ET-1含量的变化(HE染色,×400) |
2.2 preproET-1 mRNA及ETAR mRNA表达(图 2)
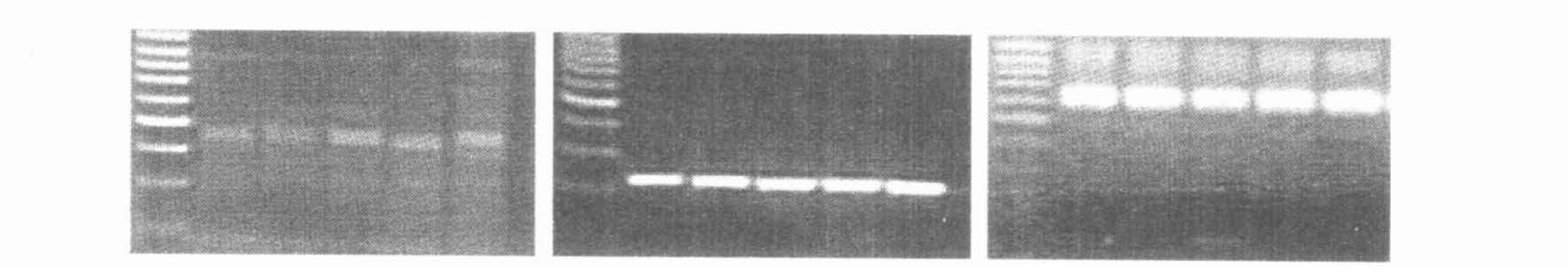
中毒后肾脏preproET-1、ETAR基因的表达明显增加。凝胶电泳结果表明,preproET-1 mRNA表达值对照组为0.15±0.02;染毒6h为0.37±0.05,是对照组的2倍多,达峰值;24h后降至0.25±0.03,但与对照组比较差异仍有统计学意义(P<0.01)。ETAR mRNA表达值对照组为0.50±0.03;染毒6h上升达峰值,为0.79±0.10,与对照组比较,差异有统计学意义(P<0.01);24h后恢复至0.52±0.04,与对照组水平相近。
|
注:a对照组;b:染毒后2h;c染毒后6h;d.染毒后12h;e:染毒后24h。 图 2 肾脏preproET-1 mRNA及ETAR mRNA表达变化 |
3 讨论
肾脏不仅是ET-1合成和分泌的重要场所,也是ET-1作用的靶器官,肾脏血管对ET-1的敏感性比支气管、冠状动脉等组织高出10倍。ET-1以自分泌或旁分泌方式调节肾脏功能,肾脏ET-1表达和释放异常是肾脏疾病发生发展的原因之一[4-6]。例如,缺血、缺氧和酸中毒等可促进肾内ET-1及其受体基因表达,ET-1合成释放增加[7, 8]。
本研究结果表明,大鼠芥子气中毒后肾脏出现明显的病理学改变,远曲小管ET-1含量显著升高。中毒后肾组织中ET-1增加,主要是由于ET-1 mRNA的转录增加所致。大鼠芥子气中毒后肾脏preproET-1基因的表达明显增加,在6h为对照组的2倍多,达峰值,与远曲小管ET-1浓度的变化相对应。ET-1只能通过与细胞膜上特异受体ETAR结合而发挥效应,芥子气中毒后ETAR mRNA的表达也显著增加。肾组织中高表达的ET-1 mRNA、ETAR mRNA使ET-1大量分泌,同时使ETAR表达上调。提示芥子气中毒后,ET-1与ETAR大量结合,产生收缩效应,导致肾血管强烈而持久地收缩,肾循环血流量减少,肾脏灌注不良,进一步导致系膜细胞收缩,肾小球超滤过系数下降,进而使肾小球滤过系数下降,损害肾功能。
| [1] | Masaki T. Historical review : endothelin[J]. Trends Pharmacol Sci, 2004, 25(4) : 219–224. DOI:10.1016/j.tips.2004.02.008 |
| [2] | Van de Water FM, Russel FGM, Masereeuw R. Regulation and ex-pression of endothelin -l (ET -1) and ET -receptors in rat epithe-lial cells of renal and intestinal origin[J]. Pharmacological Research, 2006, 54(6) : 429–435. DOI:10.1016/j.phrs.2006.08.006 |
| [3] | Kobayshi T, Miyauchi T, Sakai S, et al. Down regulation of ET (B) receptor, but not ET (A) receptor, in congestive lung secondary to heart failure : Are marked increases in circulating endothelin -1partly attributable to decreases in lung ET (B) receptor -mediated clearance of endtothelin -1[J]. Life Sci, 1998, 62(2) : 185–193. |
| [4] | Granger J P, Abram S, Stec D, et al. Endothelin, the kidney, and hy-pertension[J]. Curr Hypertens Rep, 2006, 8(4) : 298–303. DOI:10.1007/s11906-006-0068-x |
| [5] | 高维明, 张会临. 山葡萄多酚对血管内皮细胞损伤的保护作用[J]. 中国公共卫生, 2006, 22(6) : 715–716. |
| [6] | Kohan DE. The renal medullary endothelin system in control of sodium and water excretion and systemic blood pressure[J]. Curr Opin Nephrol Hypertens, 2006, 15(1) : 34–40. DOI:10.1097/01.mnh.0000186852.15889.1a |
| [7] | Brunner F, Bras -Silva C, Cerdeira AS, et al. Cardiovascular en-dothelins: essential regulators of cardiovascular homeostasis[J]. Pharmacology & Therapeutics, 2006, 111(2) : 508–531. |
| [8] | Nakas -Icindic E, Zaciragic A, Hadzovic A, et al. Endothelin in health and disease[J]. Bosn J Basic Med Sci, 2004, 4(3) : 31–34. |
 2008, Vol. 24
2008, Vol. 24

