睡眠和觉醒周期性是人类和大多数哺乳动物生存的必要条件。睡眠剥夺在夜班作业以及多种职业人群中均属于常见的应激原。有文献表明,睡眠剥夺可引起机体免疫力下降,警觉性和判断力下降,记忆力下降等变化[1, 2]。为研究睡眠剥夺对海马锥体细胞形态结构的影响,探讨睡眠剥夺后神经元损伤的机制,为睡眠剥夺损伤的防治提供依据,进行了本研究。
1 材料与方法 1.1 动物及分组选用成年健康SD 大鼠54 只,雌雄不拘,体重(180 + 20) g (第四军医大学实验动物研究中心) 。将54只大鼠随机分为6 组,1 组为正常对照组,其余5 组分别进行睡眠剥夺1~5 d ,每组9 只大鼠。饲养环境:室内温度和湿度均控制在适宜范围内[3],同时避免噪音,保持24h 光暗周期。
1.2 制备大鼠异相睡眠剥夺的模型采用多平台水环境法(Modifield multiple platform method)[4],制作大鼠异相睡眠剥夺模型。睡眠剥夺箱(30 cm ×30 cm ×150 cm) 中央放置直径为415 cm ,高8 cm 的平台数个。剥夺箱内注有水,水面低于平台2 cm ,水温保持在(20 ±2) ℃。大鼠可以在平台上活动,自由摄取食物和水,但当进入睡眠时,由于骨骼肌的松弛使大鼠掉入水中而惊醒,造成异相睡眠剥夺。
1.3 海马CA1 区锥体细胞形态的观察睡眠剥夺后,各时段大鼠均以2 %戊巴比妥钠进行腹腔麻醉,迅速开胸暴露心脏,行左心室插管经右心耳放液,先以肝素化生理盐水50~100 ml 冲去血液,再以4 %多聚甲醛磷酸缓冲液(011 mol/ L pH 714 ,4 ℃) 200~250 ml 灌注固定30~40 min 取脑组织。脑组织置于同种固定液中续固定(4 ℃,2 h) ,再置于20 %蔗糖溶液(011 mol/ L pH 714 ,4 ℃) 过夜。按PaXinos 立体定位图谱取海马,恒冷切片机连续冠状切片(Bregrnan 平面后318mm) ,片厚15μm。采用尼氏(Nissl) 染色,光镜下观察海马CA1 区锥体细胞形态的变化。
1.4 海马CA1 区锥体细胞超微结构的观察睡眠剥夺后,将各组大鼠戊巴比妥钠(40 mg/ kg) 腹腔麻醉后,断头处死,迅速取出海马,按电镜样品取材要求,3 %戊二醛、1 %锇酸双固定,常规包埋,光镜选区,制备超薄切片,铀、铅双染,100CX2II型透射电镜观察并照相。
1.5 海马CA1 区线粒体损伤后细胞色素C 水平的变化按常规链霉亲和素免疫组化法(SABC) 进行检测,按免疫组化试剂盒(福州迈新生物技术开发有限公司) 说明书操作。二氨基联苯氨(DAB) 显色。
2 结果 2.1 睡眠剥夺对大鼠海马神经元形态的影响正常对照组的海马CA1 区神经元呈梭形紧密排列,细胞轮廓清晰,胞浆透明。随睡眠剥夺时间的延长,神经元数目减少,排列紊乱,细胞轮廓模糊,出现大量空泡。
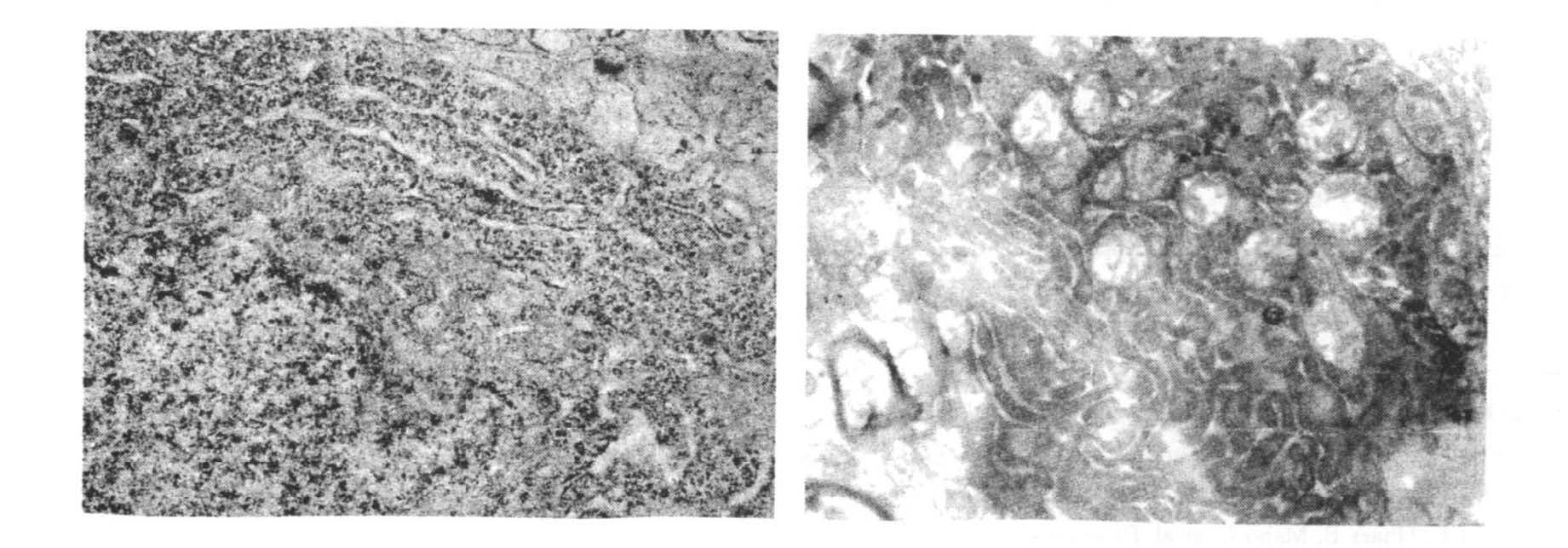
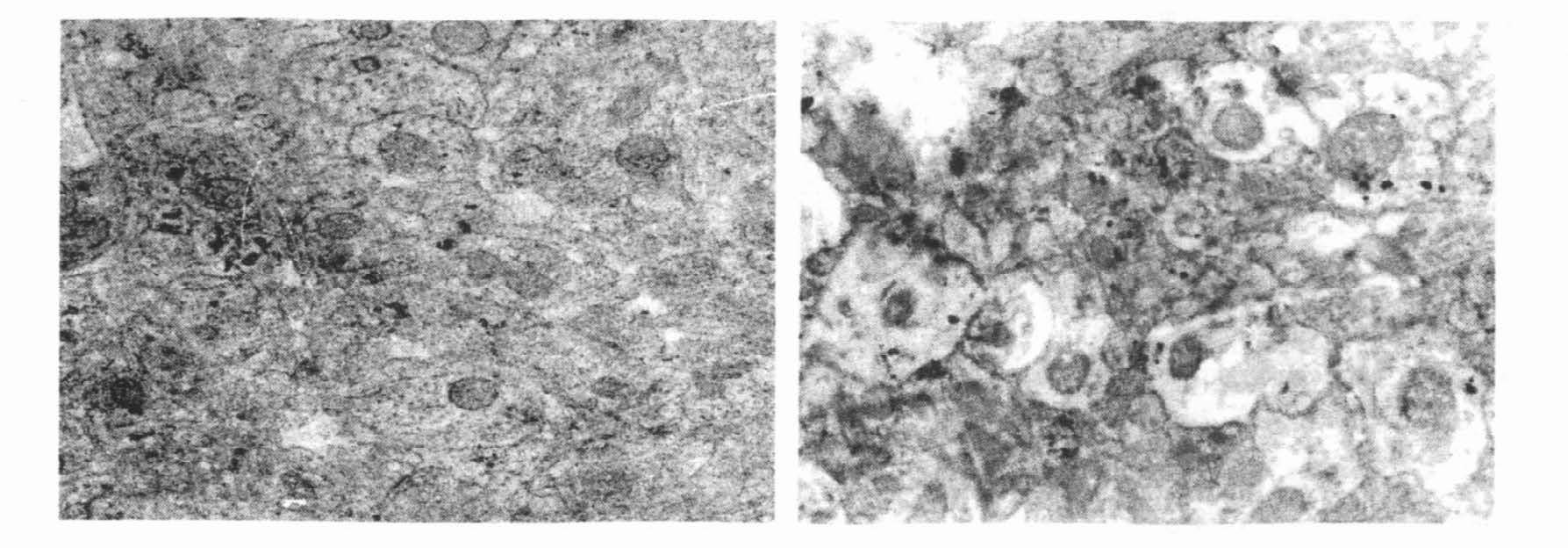
2.2 睡眠剥夺对海马CA1 区锥体细胞超微结构的影响(图 1,2)
|
图 1 睡眠剥夺后,电镜观察海马CA1 区内质网及粒体的超微结构的改变( ×1 0000) |
|
图 2 睡眠剥夺后,电镜观察海马CA1 区轴突超微结构的改变( ×1 000) |
睡眠剥夺后,海马CA1 区内质网扩张;轴突水肿明显;线粒体数目明显减少,线粒体肿胀,嵴结构模糊,紊乱,有的呈空泡样变。
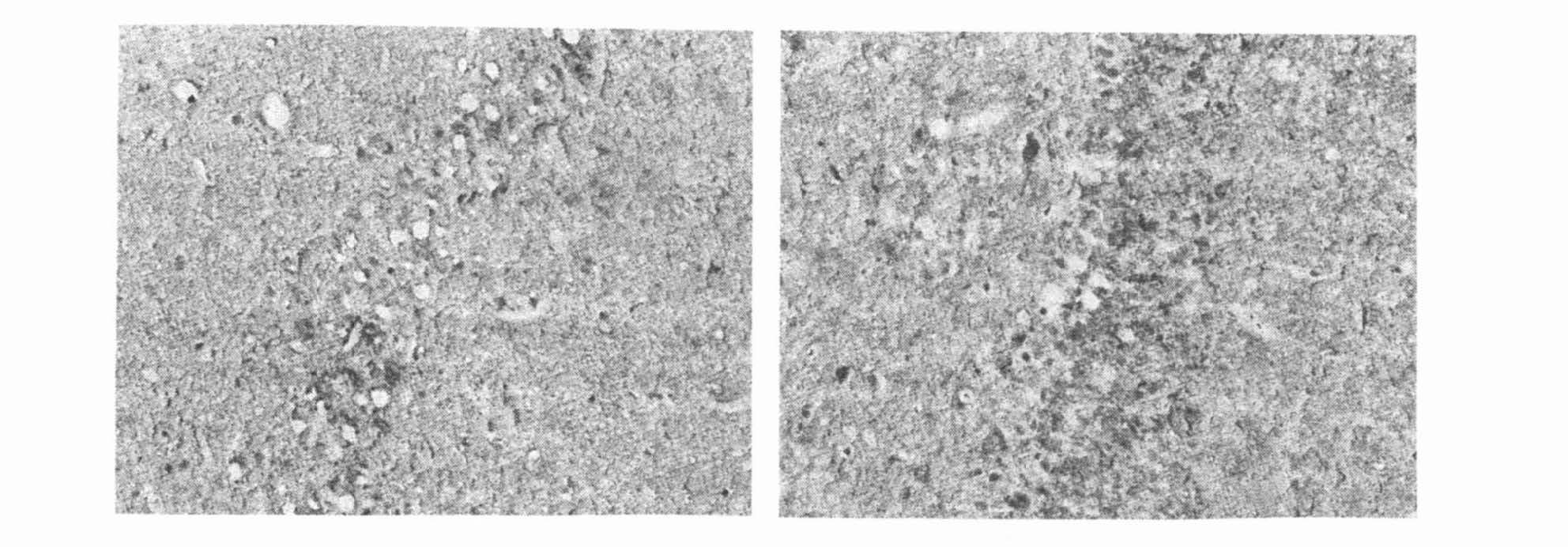
2.3 睡眠剥夺对海马CA1 区锥体神经元内细胞色素C 的影响(图 3)
|
图 3 睡眠剥夺后,海马CA1 区免疫组化染色( ×400) |
应用免疫组织化学法检测各组大鼠海马神经元内细胞色素C 的变化。结果显示,随着睡眠剥夺时间的延长,细胞色素C 免疫阳性的神经元较对照组逐渐增多,提示细胞线粒体损伤导致细胞色素C 释放入胞浆。
3 讨论在中枢神经系统中,海马是介导应激反应的最重要的脑区之一[5]。海马与学习记忆功能密切相关,对认知性应激反应尤为重要。本研究结果显示,睡眠剥夺组大鼠海马AC1 区锥体细胞排列松散,尼氏小体减少或者消失。尼氏小体是细胞合成蛋白质的场所,它的结构正常与否能够反映细胞的功能状态[6]。本实验结果证明,睡眠剥夺组的海马CA1 区锥体细胞形态发生破坏,这可能是睡眠剥夺影响学习记忆功能的机制之一。另外,透射电镜观察结果显示,睡眠剥夺后海马CA1 区的血管、轴突、线粒体等的超微结构发生异常的改变,而线粒体的损伤较为明显。免疫组织化学方法也证明神经元胞浆内细胞色素C 免疫阳性增强,表明线粒体损伤后细胞色素C 释放入胞浆[7]。本实验中睡眠剥夺后,海马神经元形态功能异常变化,线粒体受损,释放细胞色素C 至胞浆,在某种因素作用下,激活凋亡程序引起海马神经元的凋亡[8],可能与学习记忆功能密切相关,有待进一步研究。细胞色素C 是线粒体呼吸链中的一个基本成分,位于线粒体膜内并松散地附着于线粒体膜的内表面,被认为是哺乳动物细胞凋亡信号传导过程的关键因素[9]。线粒体损伤后,线粒体膜间隙的细胞色素C 释放入胞浆,与Apaf-1 结合,并激活caspase29 ,后者又激活由caspase23 介导的凋亡过程[10]。
研究表明,睡眠剥夺可引起大鼠学习记忆功能的降低,但其作用机制尚不完全清楚。本实验结果表明,睡眠剥夺可引起大鼠海马神经元超微结构的损害,线粒体的损伤更引起细胞色素C 的释放,影响神经元的存活状态,在一定程度上可解释睡眠剥夺影响学习记忆的机制。另外,线粒体是能量供应的中心,也是神经元维持正常生理功能的重要细胞器[11],改善线粒体功能可望成为睡眠剥夺损伤防治的一条新途径。
| [1] | Bueno OFA, Lobo LL, Olivedra MGM, et al. Dissociated paradoxi-cal sleep deprivation effects on inhibiting avoidance and condi-tioned fear[J]. Physiol & Behavior, 1994, 56 : 775–779. |
| [2] | Hennevin E, Hhars B, Maho C, et al. Processing of learned infor-mation in paradoxical sleep : relevance for memory[J]. Behavioral Brain Research, 1995, 69 : 125–135. DOI:10.1016/0166-4328(95)00013-J |
| [3] | 施新猷,李六金. 影响动物实验效果的动物饲养环境因素和营 养因素[M]// :施新猷. 现代医学实验动物学1 北京:人民军医 出版社,2000. |
| [4] | Deborah Sucheki, Beatyiz Duarte Palma, Sergio Tufik. Sleep re-bound in animals deprived of paradoxical sleep by the modifield multiple platform method[J]. Brain Research, 2000, 875 : 14–22. DOI:10.1016/S0006-8993(00)02531-2 |
| [5] | Robert M, Sapolsky. Why stress is bad for your brain[J]. Science, 1996, 273(5276) : 749–750. DOI:10.1126/science.273.5276.749 |
| [6] | 张艳美, 杨权, 许崇涛, 等. 慢性应激对大树海马锥体细胞形态 结构的效应[J]. 生物化学与生物物理进展, 2002, 29(5) : 719–722. |
| [7] | Kitagawa K, Matsumoto M, Mabuchi T, et al. Deficiency of inter-cellular adhesion molecular21 attenuates microcirculatory distur-bance and infaction size in focal ischemia[J]. J Cereb Blaood Flow Metab, 1998, 18(12) : 1336–1345. |
| [8] | Andreyev A, Fiskum G. Calcium induced release of mitochondrial cytochrome C by different mechanisms selective for brain versus liver[J]. Cell Death Differ, 1999, 6(9) : 825–832. DOI:10.1038/sj.cdd.4400565 |
| [9] | 王叨, 刘玉峰. 细胞色素C 与细胞凋亡的研究进展[J]. 中国小 儿血液, 2004, 9(4) : 181–184. |
| [10] | Liu X, Kim C N, Yang J, et al. Induction of apoptotic program 1 cell extracts : requirement for dATP and cytochrome c[J]. Cell, 1996, 86(1) : 147–157. DOI:10.1016/S0092-8674(00)80085-9 |
| [11] | 贾栋, 高国栋. 细胞器于缺血性神经元凋亡[J]. 中风与神经疾 病杂志, 2004, 21(3) : 286–288. |
 2007, Vol. 23
2007, Vol. 23

