2. 中山大学基础医学寄生虫学教研室
血吸虫的能量主要来源于无氧糖酵解,糖酵解途径相关酶与血吸虫的生存密切相关,可能是潜在的药物作用靶分子或疫苗候选分子。乳酸脱氢酶(LDH)是糖酵解途径的末端酶,在还原型烟酰胺腺嘌呤二核苷酸(NADH)及氧化型烟酰胺腺嘌呤二核苷酸(NAD+)辅助下催化丙酮酸还原为乳酸及乳酸氧化为丙酮酸的可逆反应。从分子水平开展血吸虫乳酸脱氢酶的酶学特性、免疫活性及抗血吸虫药物对其活性影响等方面的研究,有助于了解血吸虫乳酸脱氢酶(SjLDH)的催化特性及其在血吸虫病的免疫诊断、疫苗以及抗血吸虫药物研究方面的应用价值。本研究在已知SjLDH全长cDNA序列的基础上[1],对SjLDH进行原核表达、纯化及鉴定,以期获得有生物学活性的重组蛋白,为进一步的功能研究打下基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒重组质粒pGEX-4T-1-SjLDH、质粒pET28a(+)、大肠埃希菌BL21(DE3)为本室保存。
1.1.2 引物设计根据已知SjLDH全长编码序列设计引物:Sjldh1:GCCGAATTCATGCCGTCATCTTGT(下划线为EcoRI酶切位点),Sjldh2:GCGCTCGAGTTACCACTTAATTCC(下划线为XhoI酶切位点)(上海博亚公司合成)。
1.1.3 主要试剂Taq酶、dNTP、限制性内切酶EcoRI、XhoI、T4DNA连接酶及Marker DL2000(大连宝生物公司);质粒提取、凝胶回收试剂盒、异丙基-β-D-硫代半乳糖苷(IPTG)(上海申友公司);十二烷基硫酸钠(SDS)、丙烯酰胺、N,N’-亚甲基双丙烯酰胺、二硫苏糖醇(DTT)等(北京鼎国生物制品公司);His Bind Purification Kit(德国Novagen公司);聚醚二砜膜(PVDF)(美国Millipore公司);3,3′-二氨基联苯胺(DAB)、兔乳酸脱氢酶(rLDH)、吩嗪硫酸甲酯(phenazine methosulfate,PMS)、氯化氮篮四唑(nitroblue tetrasolium chloride,NBT)、丙酮酸(pyruvate)、乳酸(lactate)、NADH及NAD+(美国Sigma公司);96孔聚苯乙烯酶标板(美国Costar公司);小鼠抗组氨酸标签单克隆抗体(美国Invitrogen公司);羊抗小鼠辣根过氧化物酶(HRP)标记二抗(武汉博士德公司)。
1.1.4 抗原及血清日本血吸虫成虫粗抗原(AWA)为新鲜成虫匀浆上清,蛋白浓度为2.5 mg/ml。阴性血清:取10只正常昆明鼠,眼球取血,分离血清,-80℃保存备用。阳性血清:取10只昆明鼠,腹部经皮肤感染尾蚴(40±1条/只),感染后每周尾部取血,分离血清,-80℃保存备用,连续采血13周。
1.2 方法 1.2.1 SjLDH原核表达载体(pET-28a-SjLDH)的构建及鉴定参照文献[2]方法以重组质粒pGEX-4T-1-SjLDH(本实验室先前构建)为模板,将目的片段亚克隆入质粒pET-28a EcoRI、XhoI酶切点位点构建重组质粒pET-28a-SjLDH,转化大肠埃希菌BL21,重组质粒经酶切琼脂糖凝胶及测序鉴定。
1.2.2 SjLDH的原核表达及鉴定IPTG(终浓度1 mmol/L)37℃诱导pET-28a-SjLDH转化菌3 h,离心收集菌体进行聚丙烯酰胺变性凝胶电泳(SDS-PAGE),考马斯亮蓝蛋白染色液染色[2]。Western Blot鉴定:SDS-PAGE电泳,凝胶根据转移电泳装置(DYCZ-40D型,北京六一仪器厂)说明书操作,100 mA转移电泳1 h,将蛋白转印于PVDF膜。低分子量蛋白Marker用氨基黑染液染色,待鉴定PVDF膜在1∶1000的小鼠抗6×His单克隆抗体室温杂交1 h,(PBS)漂洗2次,1∶400稀释辣根过氧化物酶标记羊抗小鼠抗体室温杂交30 min,PBS漂洗2次,DAB溶液显色,超纯水终止反应。
1.2.3 重组SjLDH的纯化及鉴定相同条件诱导表达,4℃8 000 r/min离心收集菌体,重悬菌体,4℃超声破菌,12 500 r/min离心20 min,收集上清。亲和层析按试剂盒说明书进行,纯化产物进行SDS-PAGE及Western Blot鉴定。收集的纯化蛋白合并于透析袋中,pH 7.4 PBS 4℃磁力搅拌过夜,换液3次,Bradford法测定蛋白浓度,加0.1%灭菌甘油-80℃保存备用。
1.2.4重组蛋白的非变性电泳酶活性染色及酶活性测定重组蛋白的非变性电永及酶活性染色参照文献[3]方法,酶活性测定参照文献[4]方法。
1.2.5 重组蛋白的免疫活性鉴定用包被缓冲液将重组蛋白及血吸虫成虫粗抗原稀释至5 μg/ml包被96孔聚苯乙烯酶标板,常规ELISA法测定。
2 结果 2.1 SjLDH原核表达载体(pET-28a-SjLDH)的构建及鉴定(图 1)用特异性引物对原重组质粒pGEX-4T-1-SjLDH进行PCR扩增,获得一个约1 000 bp的片段,测序为999 bp,与原来结果完全相符。将扩增产物插入到质粒pET-28a构建pET-28a-SjLDH重组质粒,构建的重组质粒经PCR、双酶切琼脂糖凝胶及测序鉴定,表明重组质粒构建成功。
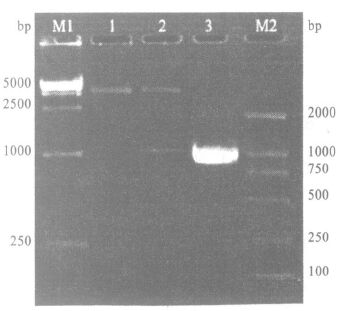
|
注:M1 :DNA marker 15 000 ;1 :pET-28a 双酶切( EcoRI + Xho I) ;2 :pET228a-SjLDH 双酶切( EcoRI + Xho I) ;3 :pET228a-SjLDH PCR 产物;M2 :DNA marke 2 000 。 图 1 pET228a-SjLDH重组质粒及PCR扩增产物的双酶切鉴定 |
2.2 目的基因的原核表达、纯化及鉴定(图 2,图 3)
pET-28a-SjLDH转化菌经诱导表达后,电泳显示,在分子量约36 kDa处出现一明显条带,与SjLDH的理论分子量为36.120kDa基本相符。菌体裂解上清经过亲和层析柱层析,获得一分子量约36kDa蛋白。由于pET系列载体表达的融合蛋白均带有6×His标签,用小鼠抗6×His单抗体Western blot。结果显示,重组菌诱导后、裂解上清以及纯化产物均有分子量约36kDa带有6×His标签的目的蛋白,即重组SjLDH。
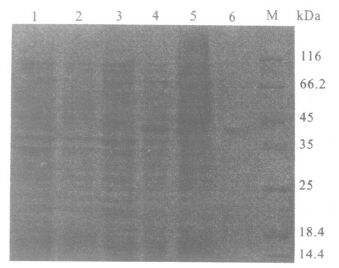
|
注:1 :pET2-8a 未诱导;2 :pET-28a 诱导后;3 :pET-28a-SjLDH 未诱导;4 :pET-28a-SjLDH诱导后;5 :pET-28a-SjLDH诱导后菌体可溶性上清;6 :纯化产物;M:低分子量蛋白marker。 图 2 pET228a-SjLDH原核表达及纯化产物的SDS2PAGE鉴定 |
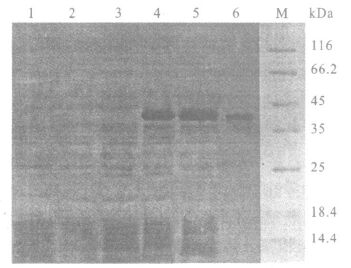
|
注:1 :pET-28a 未诱导;2 :pET-28a诱导后;3 :pET-28a-SjLDH 未诱导;4 :pET-28a-SjLDH诱导后;5 :pET-28a-SjLDH诱导后菌体可溶性上清;6 :纯化产物;M:低分子量蛋白marker。 图 3 pET-28a-SjLDH原核表达及纯化产物的Western blot 鉴定 |
2.3 重组SjLDH的酶活性染色及酶活性测定(图 4)
兔LDH及重组蛋白经非变性PAGE电泳后,进行特异性LDH酶活性染色,对照组兔LDH(1、2孔)及重组蛋白组(3、4孔)均有蓝紫色条带呈现,证明重组蛋白具有LDH酶活性,经测定重组蛋白的酶活性单位为379 U/mg。

|
注:1,2 :兔LDH;3 ,4 :重组蛋白。 图 4 兔LDH及重组蛋白酶活性染色 |
2.4 重组SjLDH的免疫活性测定(图 5)
以重组SjLDH及AWA为抗原常规ELISA法检测感染小鼠组与未感染小鼠组血清中相应的抗体。2种抗原均有良好的免疫活性,AWA略高于重组蛋白,抗体在感染1周后开始出现,随后逐渐上升,至第7周达到高峰,之后略有下降,维持在一个相对较高的水平。
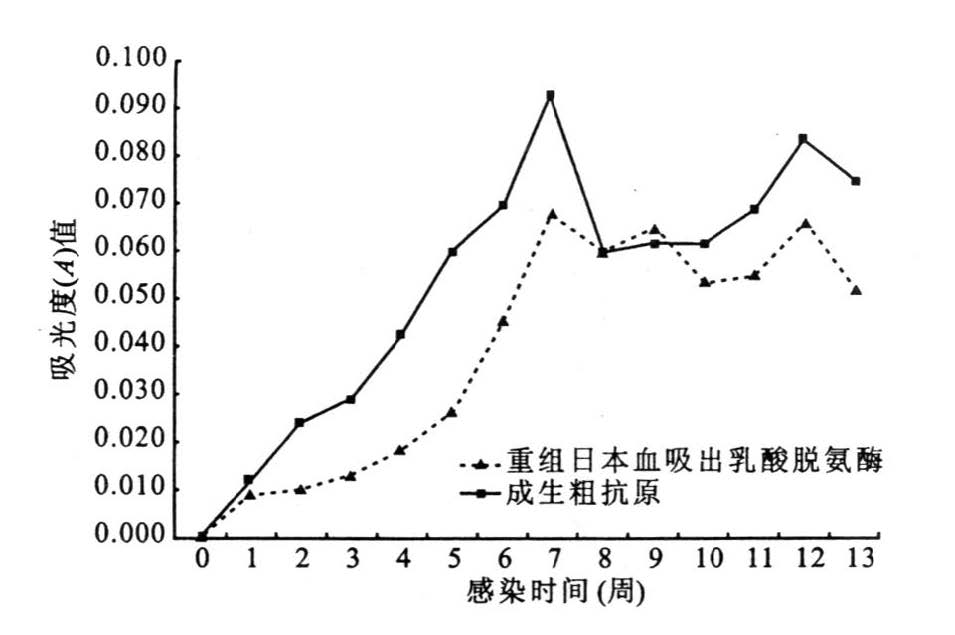
|
图 5 以重组SjLDH、AWA 为抗原ELISA 检测感染小鼠( 1~13 周) 血清抗体水平 |
3 讨论
LDH是糖酵解途径中的关键酶之一,在寄生虫生长、发育过程中起着重要作用。对疟原虫LDH(pLDH)的研究表明,pLDH与宿主动物LDH在生化、免疫学特性和酶学方面有很大差异,具有种、属特异性,是检测疟原虫理想的靶抗原以及潜在的药物作用靶标[4, 5]。吡喹酮和蒿甲醚是重要的抗血吸虫药物[6],但它们的分子作用机制目前尚未完全明了。文献报道吡喹酮对体外培养的杯尾盘殖吸虫(Cotylophoron cotylophrum)作用24 h后,虫体匀浆上清LDH活性被抑制达85%[7];用蒿甲醚灌服日本血吸虫感染小鼠24~72 h,虫体LDH活性分别被抑制9%~59%(雄性)及41%~75%(雌性)[8]。以上结果提示吡喹酮、蒿甲醚可能作用于糖酵解途径的末端酶LDH。但由于虫体药物实验影响因素较多,虫体在药物作用24 h后可能死亡或活性大大降低,不能反映真实情况,药物是否对LDH具有抑制作用需从分子水平进行验证。
本研究在获得SjLDH全长cDNA序列的基础上,成功进行了该基因在原核表达系统的可溶性表达并进行纯化,得到了具有生物学活性的重组SjLDH。鉴定结果表明,该重组蛋白具有良好的免疫活性,其抗原性与AWA相当,可能是良好的免疫诊断及疫苗的候选分子;重组SjLDH具有较高的LDH酶活性,为从分子水平探讨吡喹酮及蒿甲醚抗寄生虫药物的作用机制及筛选新的抗寄生虫药物提供了一个良好的分子模型。
| [1] | 彭寨玉, 吴忠道, 徐劲, 等. 日本血吸虫亲环素A 和乳酸脱氢酶编码基因的克隆及序列分析[J]. 中国人兽共患病杂志, 2003, 19(3) : 37–40. |
| [2] | J 萨姆布鲁克, EF 弗里奇, T 曼尼阿蒂斯, et al. 分子克隆实验指南[M].北京: 科学出版社, 2002: 19. |
| [3] | 张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 北京: >高等教育出版社, 1997: 23-24. |
| [4] | Dando C, Schroeder ER, Hunsaker La, et al. The kinetic properties and sensitivities to inhibitors of lactate dehydrogenases (LDH1 and LDH2) from toxoplasma gondii : comparisons with pLDH from plasmodium f alciparum[J]. Mol Biochem Parasit, 2001, 118 : 23–32. DOI:10.1016/S0166-6851(01)00360-7 |
| [5] | Kaushal DC, Kaushal NA. Diagnosis of malaria by detection of plas2 modial lactate dehydrogenase with an immunodot enzyme assay[J]. Immunol Invest, 2002, 31(2) : 93–106. DOI:10.1081/IMM-120004801 |
| [6] | Xiao SH. Development of antischistosomal drugs in China ,with par2 ticular consideration to praziquantel and the artemisinisns[J]. Acta Tropica, 2005, 96 : 153–167. DOI:10.1016/j.actatropica.2005.07.010 |
| [7] | Veerakumari L, Munuswamy1 N. In vit ro effect of some an2 thelmintics on lactate dehydrogenase activity of cotylophoron coty2 lophorum(Digenea : Paramphistomidae)[J]. Vet Parasitol, 2000, 91 : 129–140. DOI:10.1016/S0304-4017(00)00258-2 |
| [8] | Xiao SH, You JQ, Guo HF, et al. Effect of artemether on phospho2 rylase ,lactate dehydrogenase ,adenosine triphosphatase and glucose phosphate dehydrogenase of Schistosoma japonicum harbored in mice[J]. 中国药理学报, 1999, 20(8) : 750–754. |
 2007, Vol. 23
2007, Vol. 23

