2. 华中农业大学食品科技学院
沙门菌在自然界分布广泛,是重要的人畜共患病原菌之一。其中,肠炎沙门菌是常见的食源性致病菌,也是引起食物中毒的重要病原菌。监测食品中肠炎沙门菌的污染状况及其耐药性,对于沙门菌株病的预防与控制有非常重要的意义。本研究对武汉市售市场生鲜肉中10株肠炎沙门菌进行耐药性分析,并运用(Enterobacterial repetitive intergenic consensus,ERIC)对这10株肠炎沙门菌株进行分析。
1 材料与方法 1.1 材料(1)菌株来源:10株肠炎沙门菌由武汉市疾病控制中心微生物检验科从生鲜肉中分离得到,编号如下:300,305,13,317,400,53,438,26,314,18。(2)细菌鉴定:鉴定方法按文献[1]进行。
1.2 方法 1.2.1 药敏试验采用K-B法,药敏纸片(北京天坛生物制品药检所);大肠埃希菌ATCC25922作质控;结果判读采用美国临床实验室标准化委员会(NCCLS)标准。
1.2.2 质粒提取用碱裂解法提取细菌的质粒DNA,经0.8%琼脂糖凝胶电泳分离[2]。
1.2.3 EEICPCR方法(1)引物序列:ERICI:5′ATGTAAGCTCCTGGGGATTCA3′,ERIC2:5′AAGTAAGTGACTGGGGTGAGCG3′,由上海生工公司合成。(2)DNA模型制备:按实验室常规的酚/氯仿法提取[3]。(3)反应条件:PCR反应体总体积为20μl,其中此物CRIC1和ERIC2(100 μmol)各2 μl,dNTP(20 μmol/L)1 μl,10×PCRbuffer 2 μl,Taq酶(5U/μl)0.5 μl(酶类购自上海生工公司,dNTP(美国Premaga公司);DNA模板溶液1 μl,无菌水12.5 μl。PCR循环参数:94℃变性1 min,52℃复性1 min,72℃延伸4 min,共30个循环,72℃保温10 min,放在4℃冰箱保存(4)ERICPCR产物分析取扩增产物5 μl于1.5%琼脂糖凝胶进行电泳,电压120 V,时间40 min;溴化乙锭(EB)染胶,紫外线波长(UV)成像。
2 结 果 2.1 鉴定结果这10株菌发酵葡萄糖,不利用乳糖,靛基质、尿素、氰化钾、β-半乳糖苷为阴性,动力、赖氨酸脱羧酶、甘露醇、山梨醇为阳性;血清学检验,A-F群0多价血清凝集;0因子血清9凝集;H因子血清第一相g,m凝集。其抗原式为9;g,m。鉴定为肠炎沙门菌。
2.2 药物敏感试验结果10株沙门菌中,除菌株13对12种抗生素敏感外,其余株对12种抗生素呈现多种耐药,菌株26对抗生素耐药性较强,高达5种抗生素。10株沙门菌有7株对四环素耐药,耐药率70%,耐药率从高到低,依次为链霉素、氨苄青霉素和复方磺胺;对10株沙门菌较敏感的抗生素为孢拉定、头孢噻肟、氨曲南、环丙沙星。
2.3 质粒分析(图 1)图 1可见,所有菌株有1条共同的约20KB质粒带,但也有一些菌株有5条带,菌株300,438,314带谱相同,菌株317,400带谱相同。
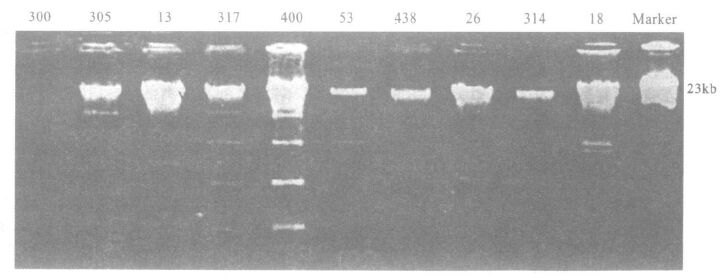
|
注:从左到右泳道依次为10株肠炎沙门菌株;Marker:λ噬菌体DNA。 图 1 10 株肠沙菌质粒提取结果 |
2.4 ERIC- PCR 扩增(图 2)
图 2 可见, PCR 产物在250~2000 bp 范围内, 各菌株扩增条带数在4~ 10 条之间。
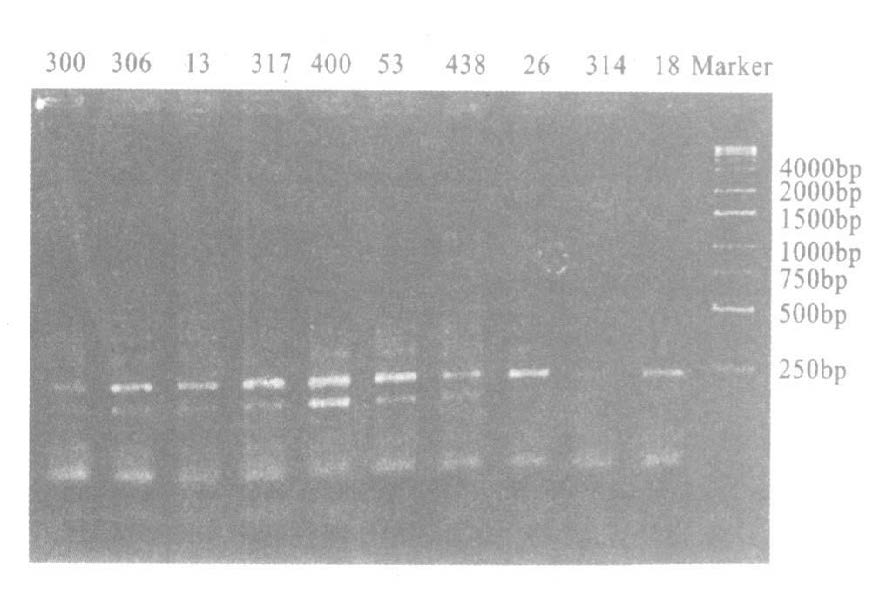
|
注: 从左到右泳道依次为10 株肠炎沙门菌株; Marker; 1kb 梯度分子量标准。 图 2 肠炎沙门菌DNA PCR 扩增结果 |
2.5 聚类分析
运用NTSYS-PC 2.0软件对上述谱带进行聚类分析,并绘制了亲缘关系树状图,10个菌株的DNA同源性在76%~99%之间。同源性为85%时,可分为3组,菌株300和菌株13聚为一组,菌株305,317,400,26,314和18聚为一组,另外2株即53和438株聚为另一组,其中菌株317,400,26,314等4株100%同源,可能为同一个传染源。
3 讨 论本文结果显示,10株肠炎沙门菌的大多数菌株耐1种或2种以上抗生素。生鲜肉类中肠炎沙门菌对四环素高度耐受,这可能与四环素类的金霉作为动物饲料添加剂长期使用分不开,动物饲养过程中抗生素的不规范使用或滥用导致了细菌对氨苄西林、链霉系和磺胺类药物的高度耐药[4, 5],对肉食细菌性食物中毒的控制和救治带来不利影响。因此,对生鲜肉中分离的肠炎沙门菌应引起重视,加大对动物性食品生产、加工、运输、储藏和销售等各个环节的有效管理,特别要加强对沙门菌耐药性的监测。
研究表明,致病菌的耐药性常与质粒有关,其质粒图谱特点的分析也有利于疾病的流行病学分析[6]。本文结果表明,菌株317和菌株400的质粒最多,菌株300,438和314的最少,但菌株400耐药性较高,菌株13敏感性较高,未发现某种或几种耐药性与某种质粒呈明显对应关系,与文献报道相似[7]。
在世界各地的食物中毒中,沙门菌引起的食物中毒病例占第1~2位[8]。因此,有必要对沙门菌的来源、亲缘关系的远近进行流行病学调查,确认所感染的菌株是否是同源,追溯食物中毒菌株的最终来源。本文结果显示,菌株305,317,400,26,314和18聚为一组,相关系数在85%以上,特别是菌株317,400,26,314,这4株100%同源,提示可能为同一个传染源。经调查发现,肉食品标本来源于同一个屠宰场,污染源为1名肠炎沙门菌携带者。结果表明,ERICPCR技术对发现传染源控制传播途径有重要意义。
| [1] | 何晓青. 卫生防疫细菌检验[M]. 南昌: 新华出版社, 1989. |
| [2] | 张振开, 黄运能, 郭炳才, 等. 副伤寒沙门氏菌耐药性与菌株质粒 的监测[J]. 中国抗生素杂志, 2004, 29(10) : 610–913. |
| [3] | 金冬雁, 黎孟枫, 侯云德, 等. 分子克隆实验指南[M]. 北京: 科学出版社, 1996. |
| [4] | 潘志明, 焦新安, 刘文博, 等. 鸡白痢沙门氏菌耐药性的监测研究[J]. 畜牧兽医学报, 2002, 33(4) : 377–383. |
| [5] | 玄承明. 常用家禽药物常识[M]. 北京: 农业科学出版社, 1995. |
| [6] | E-l Ghodban A, Chenghesh KS, Marialigeri K, et al. Serotypes, virulence f act ors, ant ibiot ic sensit ivit y, bet a-lact amase act ivit y and plasmid analysis of salmonel la f rom children w t ih diarrhea in T ripoli(Libya)[J]. Act a Microbiol Immunol Hung, 2002, 49(4) : 433–444. DOI:10.1556/AMicr.49.2002.4.2 |
| [7] | 李建栋, 陈义忠, 楚心唯, 等. 饮服从业人员沙门菌耐药性及质粒 特征分析[J]. 中国公共卫生, 2005, 21(2) : 205–206. |
| [8] | 冉陆. 食源性致病菌及食源性疾病的监测动态[J]. 中国食品卫 生杂志, 2001, 13(4) : 42–45. |
 2007, Vol. 23
2007, Vol. 23

