隐孢子虫病(Cryptosporidiosis)被认为是人类最常见的6种腹泻病之一[1, 2],目前世界卫生组织和美国疾病预防控制中心已将此病列为全球新发传染性疾病。近20年来,国内外学者在研究隐孢子虫的病原学、分子生物学及综合防治技术等方面取得许多重要成果,但在此病发病及防治方面研究较少,而临床实验又受到条件限制,所以,建立隐孢子虫感染的动物型具有重要意义。以往动物模型通常是给新生鼠[3]或者人工免疫抑制小鼠[4]或大鼠口饲隐孢子虫卵囊[5]。由于卵囊来源及活性的限制,影响了模型的建立及有关隐孢子虫生物学特性的研究。本实验通过给实验小鼠口服、皮下注射激素和环磷酰胺或者2种方法联合等5种方法,探讨一种简便快速建立小鼠隐孢子虫动物模型的新方法。现将结果报告如下。
1 材料与方法 1.1 材料地塞米松片剂(天津天药药业股份有限公司);地塞米松注射液(泗水希尔康制药有限公司);环磷酰胺粉剂(江苏恒瑞医药股份有限公司)。实验用昆明种小白鼠(大连医科大学动物中心),平均体重30 g,全部雄性。染色剂用20%碱性复红,10%稀硫酸,2 g/L孔雀绿染液。
1.2 动物分组及实验方法将39只小白鼠随机分成5组,其中1,4,5组各9只,2,3组各6只。实验前进行常规粪便中隐孢子虫卵囊检测,结果均为阴性排除感染。1组在饮水加入地塞米松11.25 mg/L,葡萄糖50 g/L;2组皮下注射地塞米松0.25 mg/只,用药从第1 d开始,每周1次;3组皮下注射环磷酰胺2 mg/只,用药从第1 d开始,每周1次;4组联合应用1,2组方法;5组联合应用1、3组方法。上述5个实验组持续观察4周,从用药后第3 d开始收集每个实验组小鼠粪便,然后采用改良抗酸染色进行隐孢子虫卵囊的检测。
1.3 隐孢子虫卵囊检测方法及观察指标通过改良抗酸染色观察小鼠粪便中卵囊情况及模型动物生存情况。每天取小鼠粪便或死亡小鼠肠内容物,放入2.5%重铬酸钾溶液中,搅拌均匀,500 r/min离心5 min,取上清加入等量蒸馏水,2 500 r/min,离心10 min,取沉淀涂片,干燥后用改良抗酸染色法染色,油镜下观察隐孢子虫卵囊出现时间、形态。
1.4 统计分析应用SPSS软件采用两独立样本非参数检验方法,分析比较其生存时间。
2 结果 2.1 隐孢虫卵囊出现时间从实验第5天起,1,4,5组小鼠粪便中均开始出现少量隐孢子虫卵囊,至第13 d数量达高峰,并持续至所有小鼠全部死亡。2,3组直至实验结束也未出现卵囊。
2.2 隐孢子虫卵囊形态油镜下蓝色背景可见被染成玫瑰红色的卵囊,圆形,囊壁透明,囊内为玫瑰红色子孢子,子孢子形态各异,成熟子孢子为月牙形。镜下还可见一些被染成玫瑰红色的非特异性颗粒,但是无囊壁及子孢子结构(图 1)。
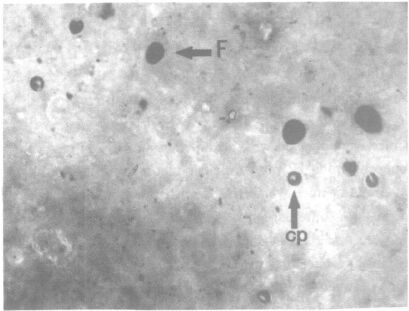
|
图 1 油镜下隐孢子虫卵囊形态 |
2.3 实验动物生存情况
实验发现:1组小鼠生存时间最短的为8 d,最长的为29 d;4组实验小鼠最短生存时间为8 d,最长的为30 d;5组小鼠最短生存时间为10 d,最长时间为19 d。求出3组小鼠中位生存时间,用SPSS软件采用两独立样本非参数检验方法比较实验1组与4组,差异无统计学意义(P>0.05);而1,4组与5组比较,生存结果差异有统计学意义(P<0.05)。
3 讨论以往学者在研究隐孢子虫动物模型时,通常采用灌胃针灌胃[6-9]、灌喂[10]、直肠接种和穿刺接种至腹膜内等方法,首先给实验幼畜或免疫抑制的动物接种一定量并具有活性的隐孢子虫卵囊,以保证造模的成功。尽管上述造模方法均能达到有效目的,但是这些方法首先要求在造模前具备一定数量的隐孢子虫卵囊,且要确保其活性,有时甚至是无菌的卵囊,增加了研究的困难。本实验采用简便方法给实验鼠口服地塞米松、皮下注射地塞米松、皮下注射环磷酰胺或者其中任何2种方法联合应用,结果所有接受口服地塞米松的小鼠均感染了隐孢子虫,并且不需要事先接种隐孢子虫卵囊,从而达到了简便快速造模的目的。Yang S等实验发现,只要给免疫抑制的C57BL/6N小鼠一个隐孢子虫卵囊即可使其感染隐孢子虫,而不给卵囊免疫抑制小鼠不会感染隐孢子虫[11]。C57BL/6N小鼠是一种清洁级小鼠,价格较贵,多用于排除多因素干扰的研究,而本实验的小鼠为一级小鼠,饲养环境及饲养条件不是无菌状态,自然环境中的隐孢子虫卵囊可以通过饮水、食物或者空气的途径,造成小鼠隐性感染,在给予这些小鼠一定剂量的免疫抑制剂作用后,引发处于隐性感染状态的原虫大量增殖及播散即呈现出显性感染。本模型适用于一般性科研及实验教学工作需要。
实验1,4组感染小鼠平均存活达到23.5 d和21 d,而且从造模后的第5 d直至实验动物全部死亡,其粪便中始终出现有隐孢子虫卵囊,从而保证了进行有关隐孢子虫生物学、免疫学和药物防治等方面研究实验动物模型所需的生存时间。
实验研究发现,实验1和4组小鼠在造模后的第5 d很快地出现隐孢子虫感染,并且2个实验组粪便中卵囊出现的时间、形态及动物生存时间均无明显差异,表明这2种方法均可用于建立小鼠隐孢子虫感染模型。而单纯皮下注射地塞米松的老鼠并未检出隐孢子虫,考虑口服地塞米松起主要作用,因此单独口服地塞米松为最简便快速的建立隐孢子虫模型的方法。实验5组小鼠平均存活时间仅12 d,明显短于实验1和4组,表明该实验组所采用的造模方法不适宜建立小鼠隐孢子虫感染模型。
| [1] | Niichiro Abe, Motohiro I. Identification of Cryptosporidium isolates from cockatiels by direct sequencing of the PCR-amplified small subunit ribososmal RNA gene[J]. Parasitol Res, 2004, 92 : 523–526. DOI:10.1007/s00436-004-1082-z |
| [2] | 沈玉娟, 曹建平. 水源性隐孢子虫的PCR检测[J]. 国外医学寄生虫病分册, 2005, 32 : 10–13. |
| [3] | Xunde Li, Philippe Brasseur. A NMRI suckling mouse model for the evaluation of infectivity of cryptosporidium parvum oocysts[J]. Chin J Parasitol Parasit Dis, 2000, 18(2) : 94–96. |
| [4] | 夏生林, 宋宏, 周海, 等. 低剂量隐孢子虫感染正常和免疫抑制小鼠的效应研究[J]. 中国病原生物学杂志, 2006, 1(2) : 120–122. |
| [5] | 郭敏, 戈建军, 沈京培, 等. 鼠隐孢子虫模型的建立[J]. 江苏预防医学, 2005, 16(1) : 58–60. |
| [6] | Mele R, Morales MAG, Tosini F, et al. Indinavir reduces cryptosporidium parvum infection in both in vitro and in vivo models[J]. Inter J Parasitol, 2003, 33 : 757–764. DOI:10.1016/S0020-7519(03)00093-6 |
| [7] | Hijjawi NS, Meloni BP, Ryan UM. Succesful in vitro cultivation of cryptosporidium andersoni:evidence for the existence of novel exrracellular stage in the life cycle and implications for the classification of cryptosporidium[J]. Inter J Parasitol, 2002, 32 : 1719–1726. DOI:10.1016/S0020-7519(02)00199-6 |
| [8] | 史长松, 任爱巧, 姚福宝, 等. 幼年大鼠隐孢子虫感染模型的建立[J]. 中国人兽共患病杂志, 1998, 14(1) : 53–60. |
| [9] | 郭步平, 连德润. 隐孢子虫动物模型的建立[J]. 中国寄生虫病防治杂志, 1997, 10 : 129–130. |
| [10] | 朱民, 张述义, 何艳燕, 等. 隐孢子虫感染小鼠动物模型的建立[J]. 中国寄生虫病防治杂志, 2003, 16 : 13–15. |
| [11] | Yang S, Benson SK, Du C, et al. Infection of immunosuppressed C57BL/6N adult mice with a single oocyst of cryptosporidium parvum[J]. J Parasitol, 2000, 86(4) : 884–887. DOI:10.1645/0022-3395(2000)086[0884:IOICAM]2.0.CO;2 |
 2007, Vol. 23
2007, Vol. 23

