2. 陕西省疾病预防控制中心健康相关产品功能实验室
杜仲(Eucommia Ulmoides Oliv)属杜仲科的单属单种,杜仲皮为传统中药。中医药学理论认为,杜仲性温,味甘、微辛,入肝肾二经,具有补肝肾、强筋骨、益腰膝、除酸痛、安胎、延缓衰老等功效[1]。研究表明,杜仲叶含有与杜仲皮相似的化学成分,药效作用亦相同[2-4]。杜仲叶中含有蛋白质、脂肪、各种氨基酸、钙和磷等营养成分,绿原酸和单宁等药用成分含量也比较高[5, 6],在中国、韩国和日本,人们已习惯于将杜仲叶作为滋补品饮用[4]。为合理开发杜仲叶资源,科学地评价杜仲叶茶的保健功能,本文探讨以杜仲叶制成的绿茶对小鼠免疫功能的影响。
1 材料与方法 1.1 材料 1.1.1 样品杜仲叶袋泡茶,杜仲绿叶按绿茶生产工艺制成的袋泡茶[爱康企业(杨凌)饮品有限公司]。杜仲叶袋泡茶样品规格为3g/袋,成人每日推荐量为每次1袋,每日3次,开水冲泡。试验时将样品225 g加10倍80~90℃的蒸馏水浸泡60 min,提取2次,将其合并浓缩至1 000 ml,此浸提液1 ml相当于0.225 g成品袋泡茶。
1.1.2 动物成年二级昆明种雌性小鼠(第四军医大学动物实验中心)200只,体重18~22 g。
1.1.3 仪器和试剂752-C紫外可见分光光度计(上海分析仪器厂);BIO-RAO酶标仪(美国伯乐公司);24孔培养板、96孔培养板、游标卡尺等;Waters 2695PDA-2996高效液相色谱系统(美国Waters公司);Z-5 000原子吸收分光光度仪(日本日立公司);AFS-230原子荧光分光光度仪(北京海光仪器公司);GC-14B气相色谱仪(日本岛津公司)。绵羊红细胞(SRBC),鸡红细胞,YAC-1细胞,印度墨汁,Hank's液,四甲基偶氮噻唑蓝(MTT)液,刀豆蛋白A(ConA),RPMI1640培养液等。
1.2 方法实验设4个组,分别以相当于人体推荐摄入量的10,20,30倍作为低、中和高3个剂量组,即1.50,3.00,4.50 g/(kg.bw),以及1个溶剂对照组(蒸馏水)。每组40只动物,每种指标测定各用10只。采取灌胃法,每日灌胃1次,按0.2 ml/(10 g·bw)经口灌胃30 d后,分别对动物进行各项免疫指标测定。试验方法按《保健食品检验与评价技术规范》[7]进行。其中迟发型变态反应(DTH)试验,采用SRBC诱导小鼠足跖增厚法(DTH);ConA诱导的小鼠脾淋巴细胞转化试验,用四甲基偶氮噻唑蓝微量酶反应比色法(MTT)。杜仲叶茶3个剂量组和对照组小鼠的淋巴细胞转化试验测定结果以吸光度(A值)和转化指数表示。脾淋巴细胞转化指数=[ConA刺激的小鼠阳性孔吸光度值(ConA+A)-ConA未刺激的小鼠阴性孔吸光度值(ConA-A)],血清溶血素的测定用血凝法;小鼠腹腔巨噬细胞吞噬鸡红细胞试验,用半体内法;天然杀伤细胞(NK细胞)活性测定用乳酸脱氢酶(LDH)测定法。理化指标检测,杜仲叶茶中绿原酸和总黄酮含量按照文献[7]分别用高效液相色谱法和分光光度法测定;水分、灰分、铜、铅、砷、汞、六六六和滴滴涕等指标分别按照GB/T5009-2003《食品卫生标准检验方法理化部分(一)》进行检测。
1.3 统计分析采用SPSS 11.0软件进行方差分析。
2 结果 2.1 杜仲叶茶化学成分检测结果对3个批号的杜仲叶袋泡茶样品进行理化指标检测,3批样品检测结果的平均值:绿原酸含量为1.20 g/100 g,总黄酮含量(以芦丁计)为465 mg/100 g,水浸出物32.0%,水分和灰分分别为5.37%和9.13%;铜、铅、砷、汞、六六六和滴滴涕含量分别为5.40,1.72,0.43,0.036,0.002和0.013 mg/kg。
2.2 杜仲叶茶对小鼠体重的影响杜仲叶茶经口给予小鼠30 d后,各剂量组小鼠各期体重及增重与溶剂对照组比较,差异均无统计学意义(P>0.05)。
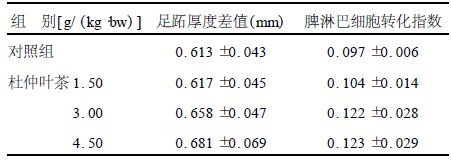
2.3 杜仲叶茶对DTH的影响(表 1)连续灌胃杜仲叶茶30 d后,各剂量组小鼠用SRBC攻击前后(间隔24 h)的足跖厚度的差值均较溶剂对照组高,且高剂量组小鼠的足趾厚度差值与对照组比较,差异有统计学意义(P<0.05)。
| 表 1 杜仲叶茶对小鼠DTH和脾淋巴细胞转化试验测定结果(x±s,n=10) |
2.4 杜仲叶茶的ConA诱导小鼠脾淋巴细胞转化试验(MTT法)(表 1)
连续灌胃30 d后,高、中剂量组小鼠脾淋巴细胞转化指数与溶剂对照组比较,差异有统计学意义(P<0.05),低剂量组小鼠脾淋巴细胞转化指数与溶剂对照组比较,差异无统计学意义(P>0.05)。
2.5 杜仲叶茶对小鼠溶血素的影响连续灌胃30 d后,杜仲叶茶高、中及低3个剂量组小鼠抗体积数与溶剂对照组比较,差异均无统计学意义(P>0.05)。
2.6 抗体生成细胞检测(PFC)杜仲叶茶经口给予小鼠30 d后,高、中及低3个剂量组小鼠的溶血空斑数与溶剂对照组比较,差异均无统计学意义(P>0.05)。
2.7 小鼠碳廓清试验连续灌胃30 d后,高、中剂量组小鼠碳廓清吞噬指数高于溶剂对照组,其差异均有统计学意义(P<0.05),低剂量组小鼠碳廓清吞噬指数与溶剂对照组比较,差异无统计学意义(P>0.05)。
2.8 小鼠腹腔巨噬细胞吞噬鸡红细胞试验(表 2)杜仲叶茶经口给予小鼠30 d后,高、中剂量组小鼠巨噬细胞吞噬鸡红细胞吞噬率和巨噬细胞吞噬指数与溶剂对照组比较,差异均有统计学意义(P<0.05);低剂量组小鼠巨噬细胞吞噬鸡红细胞吞噬率和巨噬细胞吞噬指数与对照组比较,差异无统计学意义(P>0.05)。
| 表 2 杜仲叶茶对小鼠巨噬细胞吞噬鸡红细胞试验结果(x±s,n=10) |
2.9 对NK细胞活性的影响
连续灌胃30 d后,各剂量组小鼠NK细胞活性转换值与溶剂对照组比较,差异均无统计学意义(P>0.05)。
3.10 脏/体比值测定连续灌胃30 d后,各剂量组小鼠胸腺/体、脾/体比值与溶剂对照组比较,差异均无统计学意义(P>0.05)。
3 讨论研究表明,杜仲叶中含有较高的绿原酸,本研究中所测的杜仲叶茶中绿原酸含量比国内其他地区杜仲叶中绿原酸含量的测定结果略低[5],这可能是由于杜仲叶的产地和采摘时间不同,加工方式不同,以及所采用的检测方法不同(文献[5]中采用的是比色法)。杜仲叶黄酮类化合物的结构研究显示,杜仲叶中黄酮类化合物主要是山奈酚、槲皮素、紫云英甙、陆地锦甙、芦丁等[8]。
杜仲叶的乙醇提取物可明显增强小鼠脾淋巴细胞转化功能及腹腔巨噬细胞的吞噬功能,而对正常小鼠脾抗体形成无明显影响[9]。本研究结果显示,经口给予小鼠不同剂量的杜仲叶茶30 d后,与对照组比较,杜仲叶茶对小鼠的细胞免疫功能和单核-巨噬细胞功能结果为阳性;杜仲叶茶对小鼠的体液免疫功能测定结果为阴性;各剂量组小鼠的胸腺/体重比值、脾脏/体重比值和NK细胞活性转换值与溶剂对照组比较,差异均无统计学意义(P>0.05)。这与文献[9-11]报道的相应结论基本一致。
综上所述,杜仲叶茶对小鼠的细胞免疫功能和单核-巨噬细胞功能均具有明显的增强作用,而对小鼠的体液免疫功能影响不明显。杜仲叶茶中铜、铅、砷、汞、六六六和滴滴涕含量均符合国家标准茶叶卫生标准相应的限值规定,因此,杜仲叶茶可以作为增强免疫力功能的保健食品开发利用。
(陕西省疾病预防控制中心健康相关产品功能室和理化室的部分同志参与了实验工作,在此表示感谢。)
| [1] | 庞慧民, 朱玉琢, 高久春. 杜仲对小鼠生殖细胞的遗传毒性[J]. 中国公共卫生, 2006, 22(9) : 1152. |
| [2] | 张康健, 王蓝, 张凤云, 等. 杜仲叶与皮有效成分含量比较研究[J]. 西北林学院学报, 1996, 11(2) : 42–46. |
| [3] | 赖娟华, 徐丽瑛, 饶华, 等. 杜仲叶化学成分和药理作用研究概况[J]. 实用中西医结合临床, 2004, 4(2) : 67–68. |
| [4] | 小池胜也,高桥周七.杜仲叶化学成分的季节变化[C].首届国际杜仲学术会议文集,北京:中国林业出版社,1999:154-155. |
| [5] | 张军民, 高振川, 张琪, 等. 杜仲叶及提取物营养价值和药用成分研究[J]. 氨基酸和生物资源, 2002, 24(1) : 1–2. |
| [6] | 晏媛, 郭丹. 杜仲叶化学成分及药理活性研究进展[J]. 中成药, 2003, 25(6) : 491–492. |
| [7] | 卫生部卫生监督司.保健食品检验与评价技术规范[S].2003:22-34,308. |
| [8] | 成军, 赵玉英, 崔育新, 等. 杜仲叶黄酮类化合物的研究[J]. 中国中药杂志, 2000, 25(5) : 284–286. |
| [9] | 薛程远, 曲范仙, 刘辉, 等. 杜仲叶乙醇提取物对小鼠免疫功能的影响[J]. 甘肃中医学院学报, 1998, 15(3) : 50–52. |
| [10] | 徐诗伦, 周厚琼, 黄武光, 等. 杜仲对机体非特异性免疫功能的影响[J]. 中草药, 1983, 14(8) : 27–28. |
| [11] | 徐诗伦, 曾庆卓, 潘正兴. 杜仲对细胞免疫功能的影响[J]. 中草药, 1985, 16(9) : 15–17. |
 2007, Vol. 23
2007, Vol. 23

 , 汪改宁2, 吴华2
, 汪改宁2, 吴华2