微波是频率在300 MHz~300 GHz之间的一种非电离辐射,它作为一种新技术,已经被广泛应用,其辐射损伤效应也越来越受到关注。研究表明,神经系统是微波辐射最为敏感的靶部位。突触是神经元间信息传递的特化结构,在突触前结构中,大多神经递质和神经活性物质储存在突触囊泡中,通过胞吐作用释放出来,其中几种突触囊泡相关蛋白改变其活性以助于神经递质释放,如突触素(synapsin)通过磷酸化影响递质释放,突触囊泡膜上的囊泡相关膜蛋白(vesicle-associated membrane protein,VAMP)、突触体相关蛋白(synaptosome-associated protein of 25000,SNAP-25)和突触前膜上的突触融合蛋白(symaxin)形成SNARE(soluble N-ethylmaleimide attachment protein receptor)复合体,参与囊泡与前膜的融合以及递质释放[1];突触囊泡上的突触囊泡蛋白(synaptophysin)参与形成融合微孔,使递质释放于突触间隙[2]。研究表明,微波辐射可引起突触结构、神经递质的改变[3, 4],而微波辐射对突触囊泡相关蛋白的影响报道较少。为此,本研究主要探讨微波辐射后突触囊泡相关蛋白突触素I,SNARE复合体中VAMP-2和突触融合蛋白以及突触囊泡蛋白表达的改变,为揭示微波辐射致突触传递改变的机制提供基础依据。
1 材料与方法 1.1 动物分组与辐射方法二级Wistar雄性大鼠25只,体重(18020) g(军事医学科学院实验动物中心)。动物随机分为假辐射组和30 mW/cm2组。其中假辐射组放于辐射盒内后置于辐射台上5 min,不给予辐射。采用微波模拟源进行全身均匀辐射,平均功率密度为30 mW/cm2,辐射时间为5 min。各组大鼠于辐射后6 h,1,3和7 d,麻醉,断头处死,每个时间点5只。
1.2 突触体蛋白制备方法采用蔗糖梯度离心法制备大脑皮层和海马突触体[5]:取假辐射组和30 mW/cm2组大鼠脑组织,分离大脑皮层和海马,混合后按1:100(W:V)加入0.32 mol/L蔗糖后匀浆,初离心得到去核上清液。去核上清液覆加于1.5 ml 1.2 mol/L蔗糖表面,离心后收集中间带。中间带用0.32 mol/L蔗糖稀释3~3.5倍后,覆加于1.5 ml 0.8 mol/L蔗糖表面,离心,得到离心管底部的突触体。测定突触体的蛋白浓度,悬浮于Na-Pss,4℃保存。之后收集突触体,提取突触体蛋白,-70℃保存。
1.3 免疫蛋白印迹法检测突触囊泡相关蛋白表达制备突触体蛋白后,电泳,转膜,封闭;加兔抗突触素I多抗(美国Chemicon公司)或鼠抗突触囊泡蛋白单抗(武汉博士德生物技术有限公司)或兔抗VAMP-2单抗(日本Wako公司)或鼠抗突触融合蛋白单抗(美国Sigma公司),再加入二抗;最后采用发光底物试剂盒显影。将目的条带扫描后应用CMIAS-II图像分析仪,检测目的条带的积分吸光度(integral absorbency,IA)值,将扫描值与-肌动蛋白(B-actin)扫描值相比,然后以样本/内参照的比值表示突触素I/突触囊泡蛋白/VAMP-2/突触融合蛋白蛋白表达水平。
1.4 免疫共沉淀法检测VAMP-2和突触融合蛋白相互作用取300 g突触体蛋白加裂解液补足至250 l;加5 l兔抗VAMP-2单抗,摇床4℃震摇1 h;加20 l蛋白-A琼脂微球(protein-A agarose,美国 Santa crutz 公司),4℃摇过夜。2?500 r/min 离心5 min,弃上清,收取琼脂微球沉淀;加入冰浴裂解液洗4次,离心取沉淀;加入20 l裂解液及20 l上样缓冲液;100℃水浴3 min,4 000r/min离心10 min,使琼脂微球沉淀,取上清;进行免疫蛋白印迹,一抗加鼠抗突触融合蛋白单抗(1:1 000)。显影后,将目的条带扫描后应用CMIAS-II图像分析仪,测目的条带的IA值。
1.5 统计分析采用SAS软件进行具有一个重复测量的两因素方差分析。
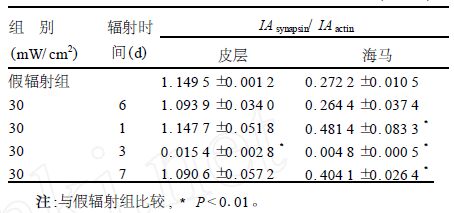
2 结 果 2.1 微波辐射后大鼠大脑皮层和海马突触素I表达的改变皮层突触体突触素I表达于辐射后3 d,明显减少(P<0.000 1);而海马于辐射后1 d显著增加(P<0.000 1),3 d减少(P<0.000 1),7 d又显著增加(P<0.001 4),见图 1和表 1。

|
注:A ,C:分别为大脑皮层和海马突触素I 表达;B ,D :分别为大脑皮层和海马β-肌动蛋白表达;1 :假辐射组;2 ,3 ,4 ,5 :分别为30 mW/ cm2 辐射后6 h ,1 ,3 和7 d。 图 1 大鼠大脑皮层和海马突触体突触素I 表达的免疫印迹结果 |
| 表 1 微波辐射后突触素I表达的定量分析结果( x ±S) |
2.2 微波辐射后突触囊泡蛋白表达的改变
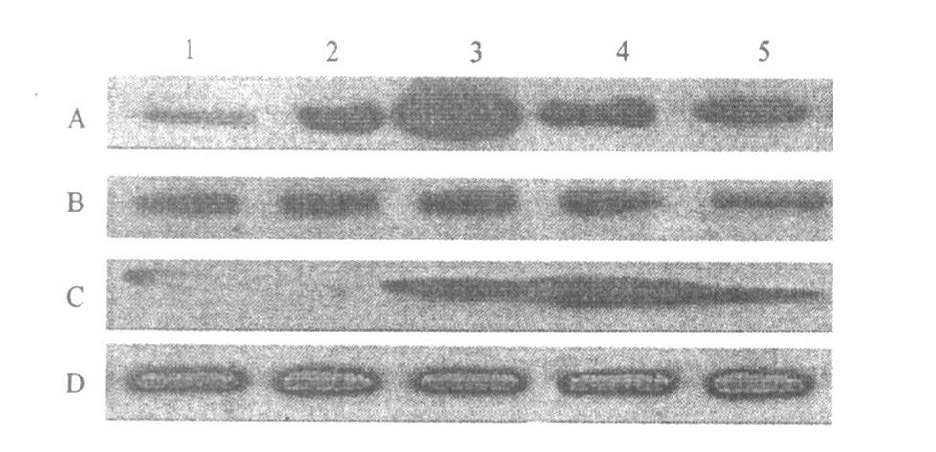
皮层突触体在辐射后6h即可见突触囊泡蛋白表达明显增加(P=0.000 4),1 d最为显著(P<0.000 1),之后逐渐恢复,7 d仍未恢复正常(P<0.000 1)。海马突触体在辐射后1 d可见突触囊泡蛋白表达明显增加( P< 01000 1) ,3 d 最为显著( P< 01000 1) ,7 d仍未恢复正常( P<01000 1) ,见图2 。
|
注:A ,C:分别为大脑皮层和海马突触囊泡蛋白表达;B ,D :分别为大脑皮层和海马-β肌动蛋白表达,1 :假辐射组;2 ,3 ,4 ,5 :分别为30 mW/ cm2 ,辐射后6h ,1 ,3 和7 d。 图 2 大鼠大脑皮层和海马突触体突触囊泡蛋白表达的免疫印迹结果 |
2.3 微波辐射后VAMP-2表达的改变
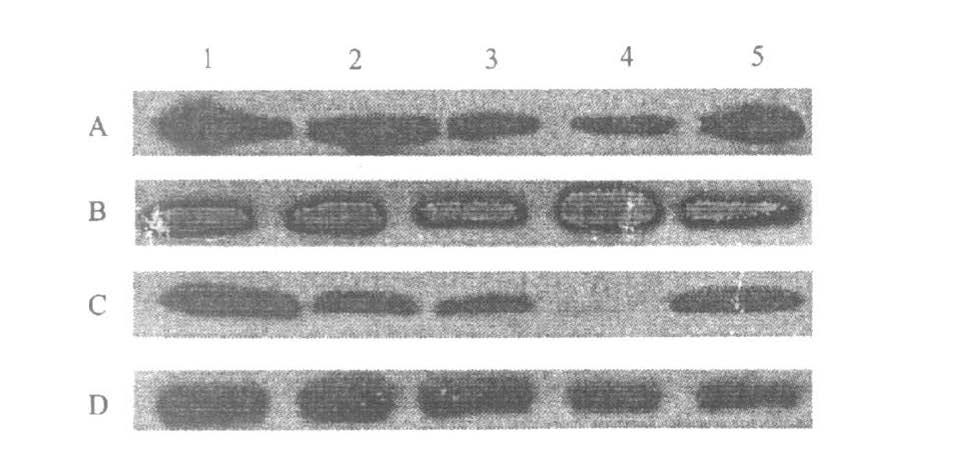
皮层突触体在辐射后1d可见VAMP-2表达明显减少(P<0.000 1),7 d基本恢复正常(P=0.545 1)。海马突触体在辐射6 h可见VAMP-2表达明显减少(P<0.000 1),3 d最为显著(P<0.000 1),7 d基本恢复正常(P<0.216?6),见图 3。
|
注:A ,C:分别为大脑皮层和海马VAMP - 2 表达;B ,D :分别为大脑皮层和海马β-肌动蛋白表达;1 :假辐射组;2 ,3 ,4 ,5 :分别为30 mW/ cm2 辐射后6 h ,1 ,3 和7 d。 图 3 大鼠大脑皮层和海马突触体VAMP22 表达的免疫印迹结果 |
2.4 微波辐射后突触合蛋白表达的改变
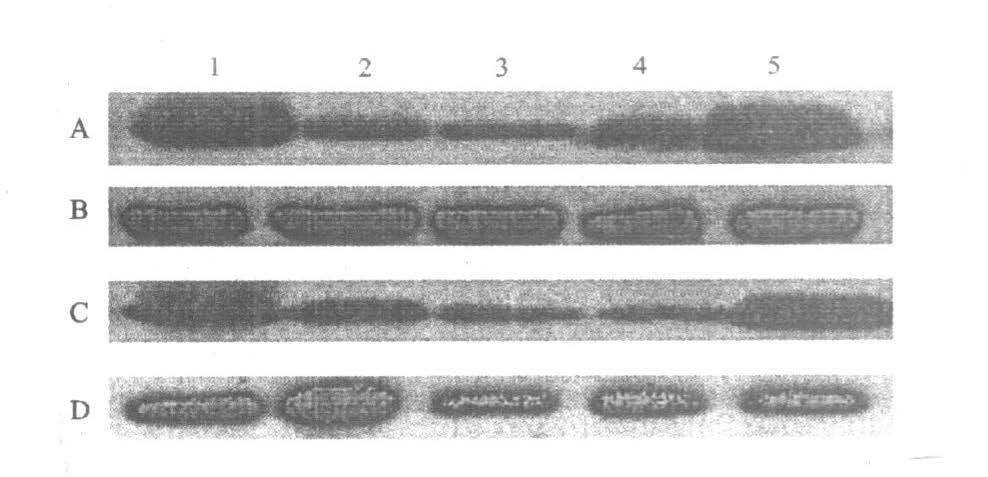
皮层突触体在辐射后6 h~3 d可见突触融合蛋白表达明显减少(P<0.000 1),7 d基本恢复正常(P=0.237?0);海马突触体在辐射后6 h~3 d可见突触融合蛋白表达明减少(P<0.001),7 d时又明显增加(P<0.000 1),见图 4。
|
注:A ,C:分别为大脑皮层和海马突触融合蛋白表达;B ,D :分别为大脑皮层海马β-肌动蛋白表达;1 :假辐射组;2 ,3 ,4 ,5 :分别为30 mW/ cm2 辐射后6 h ,1 ,3 和7 d。 图 4 大鼠大脑皮层和海马突触体突触融合蛋白表达的免疫的印迹结果 |
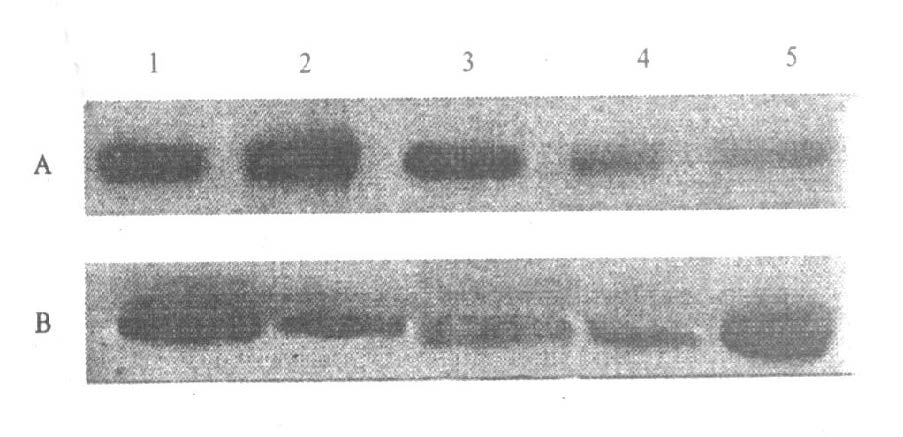
2.5 微波辐射后VAMP-2和突触融合蛋相互作用的改变
皮层在辐射后3 d二者相互作用量减弱(P<0.000 1),7 d仍未恢复正常(P<0.000 1);海马在辐射后6h即可见二者相互作用量减弱(P<0.000 1),3 d尤为显蓍(P<0.000 1),7 d仍未恢复正常(P<0.000 1),这种改变一方面可能是分子相互作用减弱,另一方面可能与2种蛋白表达量减少有关,见图 5。
|
注:A ,B:分别为在脑皮层和海马VAMP22 与突触融合蛋白相互作用结果;1 :假辐射组;2 ,3 ,4 ,5 :分别为30 mW/ cm2 辐射后6 h ,1 ,3 和7 d。 图 5 大鼠大脑皮层和海马突触体VAMP22 和突触融合蛋白相作用的免疫印迹结果 |
3 讨 论
近年来,很多学者就微波辐射效应进行了实验研究[6, 7]。学习记忆的神经生物学基础是突触可塑性,突触传递的改变在突触可塑性中至关重要,神经递质主要通过突触胞吐来发挥功能,其中几种突触囊泡相关蛋白改变其活性以助于神经递质释放,研究表明,微波辐射可引起神经递质含量和释放的改变[8]。
突触素通过其磷酸化参与突触囊泡内容物的释放,突触素家族包括突触素I、II和III,其中突触素I研究较透彻,且在胞吐过程中发挥主要作用[9, 10]。本研究发现,30 mW/cm2微波辐射后皮层突触素I表达减少可能导致递质释放障碍;而海马突触素I表达呈波动趋势,总的来看升高,这与皮层的改变相矛盾,但突触素I表达增加是否引起递质释放增加并不确切,尚需检测突触素I磷酸化的改变。
突触囊泡与突触前膜融合内化从而释放内容物的过程中,需要几种突触囊泡蛋白和突触前膜蛋白的相互作用[11]。其中突触囊泡膜上的VAMP与突触前膜上的SNAP-25和突触融合蛋白形成SNARE复合体,起始融合过程。本研究发现,皮层和海马VAMP-2和突触融合蛋白表达在30 mW/cm2微波辐射后7 d内均明显降低,二者相互作用量也明显减弱。后者一方面可能是分子相互作用减弱,另一方面可能与2种蛋白表达量减少有关。但只要二者相互作用量减少即表明神经递质释放存在障碍。这与前面突触素I表达改变比较,皮层改变基本一致,但海马却相反,表明皮层突触囊泡在锚定前以及融合均存在障碍;而海马突触囊泡锚定前的过程代谢活跃,但融合过程存在障碍。
本研究发现,30 mW/cm2微波辐射后皮层和海马突触囊泡蛋白表达均显著增加,但是否更多的突触囊泡蛋白与VAMP分离,参与了融合孔的开启而导致递质释放的增加并不确切。根据微波辐射后SNARE复合体的改变,可以初步判定突触囊泡蛋白表达的增加是一种代偿性的反应。综上所述,30 mW/cm2微波辐射大鼠可引起突触功能异常,进而可能导致突触传递障碍。
| [1] | Cesare M, Giampietro S, Sergio P. SNARE complexes and neu2 roexocytosis :how many,how close ?[J]. Trends in Biochemical Sciences, 2005, 30(7) : 367–372. DOI:10.1016/j.tibs.2005.05.002 |
| [2] | Flavia V, Maria P, Dario B, et al. Synaptophysin :leading actor or walk2on role in synaptic vesicle exocytosis ?[J]. Bio Essays, 2004, 26(4) : 445–453. |
| [3] | 刘朝晖, 王小娟, 陈景藻, 等. 毫米波辐射对大鼠下丘脑及海马化合物含量的影响[J]. 中华物理医学与康复杂志, 2002, 24(6) : 363–364. |
| [4] | Testylier G, Tonduli L, Malabiau R, et al. Effect of exposure to low level radiofrequency fields on acetylcholine release in hip2 pocampus of freely moving mouse[J]. Bioelectromagnetics, 2002(230) : 249–255. |
| [5] | Brito MA, Brites D, Butterfield DA. A link between hyperbiliru2 binemia,oxidative stress and injury to neocortical synaptosomes[J]. Brain Research, 2004, 1026(1) : 33–43. DOI:10.1016/j.brainres.2004.07.063 |
| [6] | 王丽峰, 胡向车, 彭瑞云, 等. 高功率微波辐射后小鼠行为学变化研究[J]. 中国行为医学科学, 2005, 214(1) : 32–34. |
| [7] | Yamaguchi H, Tsurlta G, Ueno S, et al. 1439 MHz pulsed TDMA fields affect performance of rats in a T2maze task only when body temperature is elevated[J〕[J]. Bioelectromagnetics, 2003, 24(4) : 223–230. DOI:10.1002/bem.10099 |
| [8] | 王丽峰, 彭瑞云, 胡向军, 等. HPM 对大鼠大脑结构及其神经质的影响[J]. 中国公共卫生, 2005, 21(9) : 1059–1060. |
| [9] | Bloom, O, Evergren E, Tomilin N, et al. Coloaclization of synapsin and actin duing synaptic vesicle recycling[J]. J Cell Biol, 2003, 161(4) : 737–747. DOI:10.1083/jcb.200212140 |
| [10] | Girler D, X u, Y, kao HT, et al. Molecular determinants of synapsin targeting to presynaptic terminals[J]. J Neurosci, 2004, 24(14) : 3711–3720. DOI:10.1523/JNEUROSCI.5225-03.2004 |
| [11] | 蔡倩, 陆佩华, 盛祖杭. 神经末梢突触囊泡释放神经递质过程的调控蛋白[J]. 生理科学进展, 2003, 34(1) : 6–10. |
 2007, Vol. 23
2007, Vol. 23

 , 胡向军
, 胡向军