2. 郑州大学基础医学院药理学教研室;
3. 71320部队门诊部
2. Department of Pharmacology, College of Basic Medical Sciences, Zhengzhou University, Zhengzhou 450052, China
RNA干扰是一种由双链RNA介导,转录后mRNA水平关闭相应序列基因表达的过程,也就是序列特异性转录沉默[1]。自发现以来,RNA干扰一直是生命科学研究的热点,并成为研究基因功能和肿瘤基因治疗的重要工具。随着抗肿瘤新药的不断开发,化疗方案的不断改进,化疗在肿瘤综合治疗中的地位和作用日益重要。但肿瘤细胞产生多药耐药(multidrug resistance, MDR)己成为肿瘤临床化疗失败的一个主要原因。MDR形成机制复杂,近年来研究发现葡萄糖神经酰胺合成酶(glueosylceramide synthase,GCS)的高表达与肿瘤MDR有密切关系[2]。本研究通过设计针对GCSmRNA的干扰序列,构建GCS siRNA真核表达载体,并转染肿瘤细胞,观察其对GCS表达以及对转染细胞耐药性的影响,为深入研究MDR产生的分子机制及逆转肿瘤MDR提供依据。现报告如下。
1 材料与方法 1.1 材料 质粒pSUPER EGFP,大肠埃希菌JM109(郑州大学基础医学院组织学与胚胎学教研室保存);人胃癌细胞株(SGC7901) 、人耐长春新碱的胃癌细胞株(SGC7901/VCR)(第四军医大学西京医院消化病研究所惠赠,本室传代培养);RPMI-1640培养基(美国Gibco公司);胃癌长春新碱(VCR)(广州白云山明兴制药有限公司);质粒提取试剂盒、胶回收试剂盒均(美国Qiagen公司);限制性内切酶Bgl

根据siRNA的设计原则[3],在GCS编码序列中设计GCS siRNA的特异靶序列,寡核苷酸序列两端包含酶切位点,能直接与经相同酶切的载体连接。设计的GCS siRNA序列如下:正义链:5-GATCCCCCCTGGAAACATTCTTTGAATTCAAGAGATTCAAAGAATGTTTCCAGGTTTrTGGAAA-3反义链:5-AGCTTTTCCAAAAACCTGGAAACATTCTTTGAATCTCTTGAATTCAAAGAATGTTTCCAGGGGG-3,寡核苷酸由上海生工生物工程技术服务有限公司合成。将合成的寡核苷酸单链稀释,各取2l,加入46l退火缓冲液,混匀,95℃水浴4min,70℃孵育10min,缓慢冷却至室温,得到退火双链DNA。将退火产物与经Bgl


胃癌细胞SGC7901/VCR以1640培养基常规培养,细胞培养液中加入VCR1.0g/ml以维持其相应的耐药表型。于实验前无药培养2周。将对数生长期细胞于转染前24h接种于24孔板,采用脂质体介导的方法[4]将GCSsiRNA真核表达载体及空载体按质量比10:1比例转染SGC7901NCR,按LipofectamineTM2000说明书进行操作。
1.2.3 Western Blot检测G-CS蛋白的表达收集转染的细胞,以磷酸盐缓冲液(PBS)漂洗,根据细胞量加入适量的细胞裂解液提取蛋白质。Bradford法[5]测定蛋白质浓度。蛋白样品与等体积上样缓冲液混合,100℃水浴5min,待完全冷却后,每个样品取等量蛋白用10%十二烷基磺酸钠(SDS)聚丙烯酰胺凝胶电泳分离。将凝胶中的蛋白质转移至NC膜上,丽春红染色观察转印情况。5%脱脂奶粉封闭,加GCS抗体,4℃孵育过夜,再加入羊抗兔二抗室温振荡孵育1h,以DAB显色,双蒸水洗终止反应,观察并照相。
1.2.4 MTT法检测细胞对长春新碱的耐药性将转染48h后的各组细胞调整浓度为2105个/ml,接种于96孔板,培养过夜后将VCR按不同浓度分别加入细胞中,每个浓度设3个复孔,继续培养48h,按常规方法加入MTT、二甲基亚矾(DMSO),于570 nm测各孔吸光度值(A)。计算肿瘤细胞抑制率:肿瘤细胞抑制率(%)=(平均A对照-平均A加药)/平均A对照100%,然后以肿瘤细胞抑制率为纵坐标,药物浓度的对数为横坐标,制作半对数图,计算50%细胞生长抑制所需的药物浓度(IC50) ,依据IC50计算相对逆转率:相对逆转率=(IC50A-IC50B)/(IC50A-IC50C)100%。其中A为SGC7901/VCR细胞,B为转染质粒的细胞,C为SGC7901细胞。
2 结果 2.1 GCSsiRNA重组质粒的酶切鉴定 重组质粒用EcoRiv和Hind
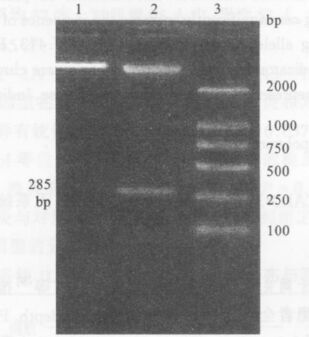
|
注: 1: pSUPER; 2: pSU PER GCS; 3: DL2000 marker。 图 1 pSUPER siRNA 重组质粒酶切鉴定 |
2.2 Western Blot检测GCS蛋白表达的变化
3组细胞经Western Blot分析,表达的GCS蛋白分子量约为38kDa。从其结果可见,各蛋白在上样量相同的条件下转染重组质粒组细胞GCS蛋白条带着色度较空载体组和未转染组明显减弱(图 2)。
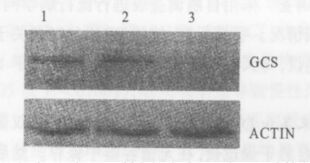
|
注: 1: SGC7901/ VCR; 2: pSUPER- SGC7901/ VCR; 3: pSUPER GCS-SGC7901/ VCR。 图 2 转染pSUPER GCS对SGC7901/ VCR 细胞GCS 表达的影响 |
2.3 细胞对长春新碱耐药性的变化
转染pSUPER GCS重组质粒后,细胞对长春新碱的IC50值为(10.870.14) mg/L,相对逆转率为81.34%,而转空载体组的IC50值为(49.920.10) mg/L,相对逆转率为2.98%,两者比较差异有统计学意义(P<0.01) ,可见pSUPER GCS重组质粒可以明显逆转SGC7901/VCR细胞对化疗药物的耐药性。
3 讨论多药耐药(multidrug resistance, MDR)是指肿瘤细胞对一种抗肿瘤药物产生耐药性后,对其他结构不同、作用靶位各异的多种抗肿瘤药物也产生交叉耐药性[6]。近年来发现,GCS高表达与肿瘤MDR密切相关。神经酰胺糖基化水平的提高是肿瘤细胞MDR的一个新机制[7]。
葡萄糖神经酰胺合成酶是调控神经酰胺代谢的关键酶之一其活性增高被认为是引起肿瘤获得性多药耐药产生的原因之一。有研究显示,GCS在人口腔表皮癌细胞[8]、人黑色素瘤细胞[9]、人乳腺癌细胞及白血病细胞中均有表达,并在耐药细胞株中呈高表达[10]。我们在前期工作中也发现,GCS在耐长春新碱的胃癌细胞系SGC7901/VCR中高表达[11],表明GCS参与了肿瘤细胞多药耐药的形成。GCS在多种恶性肿瘤耐药细胞中的表达增高,提示降低或封闭GCS的表达或许能成为逆转肿瘤耐药的新途径。本文结果显示,GCS siRNA可以有效抑制SGC7901/VCR细胞中GCS的表达,使该细胞对VCR的敏感性增强,提示GCSsiRNA表达戴体可能会成为逆转胃细胞多药耐药和胃癌基因治疗的一种新手段。这为针对GCS基因的肿瘤靶向治疗和逆转肿瘤细胞的多药耐药提供了理论基础。
| [1] | Elbashir SM,Harborth J, Lendeckel W, et al.Duplexes of 21-nucleot ide RNAs mediat e RNA int erf erence in cultured mammalian cell[J].Nature, 200l, 411(6836): 404-498. |
| [2] | Morjani H, Aouali N, Belhoussine R, et al.Elevation of glucosylceramide in mult idrug-resist ant cancer cells and accumulat ion in cytoplasmic droplet s[J].Int J Cancer, 200l, 94(2): 157-165. |
| [3] | Tuschl T. Expanding small RNA int erf erence[J]. Nat Biot echnol, 2002, 20 : 446–448. DOI:10.1038/nbt0502-446 |
| [4] | J 萨姆布鲁克, D W 拉塞尔(著), 黄培堂(主译).分子克隆实验指南[M].3 版.北京: 科学出版社, 2003: 1276-1281. |
| [5] | Smith JA. Using the Bradford method to det ermine prot ein concent rat ion[M].Beijing: S c-i ence Press, 1998: 332-333. |
| [6] | Volm M. Mult idrug resistan ce and it s reversal[J]. Anficancer Res, 1998, 18(4c) : 2905–2909. |
| [7] | Kohyama-Koganeya A, sasamt traT, Oshima E, et al.Drosophila glucosylceramide synthase: a negat ive regulator of cell death m ed-i at ed by proapopt ot ic factors[J].J Biol.Chem, 2004, 279 (34 ): 35995-36002. |
| [8] | Gouaze V, Yu JY, Bleicher RJ, et al. Overexpression of glicpsylceramide synthase and P-glycoprot ein in cancer cells select ed f or resistan ce to natural product chemotherapy[J]. Mol Cancer T her, 2004, 3(5) : 633–639. |
| [9] | Weiss M, Het tmer S, Smit h P, et al. Inhibit ion of melanoma tumor grow th bv a novel inhibitor of glucosylceramide synt hase[J]. Cancer Res, 2003, 63(13) : 3654–3658. |
| [10] | Uchida Y, Itoh M, Taquchi Y, et al. Ceranlide reduct ion and transcriptional up-regulat ion of glucosylceramide synthase th rough doxombicin-act ivat ed S pl indrug-resistant HL-60/ADR cells[J]. Cancer Res, 2004, 64(17) : 6271–6279. DOI:10.1158/0008-5472.CAN-03-1476 |
| [11] | 张艳, 刘宗文, 贾丹辉, 等. 葡萄糖神经酰胺合成酶基因在人胃癌细胞SGC7901 及SGC7901/VCR 的表达和意义[J]. 世界华人消化杂志, 2007, 15(9) : 1008–1011. |
 2007, Vol. 23
2007, Vol. 23
