2. 兰州大学临床医学院
2. Institute of Pathophysiology, Basic Medical College, Lanzhou University, Lanzhou 730000, China
人-防御素-2(human -defensin-2,hBD2)是内源性抗生肽的一个重要成员,具有广谱高效的抗微生物作用[1, 2],并且未发现有耐药菌株产生[3]。在因抗生素的大量使用而耐药菌株日益增多的今天,hBD2作为新型抗感染药物的开发应用前景更加受到重视。由于hBD2在人体正常组织中含量很少,分离纯化难度大,通过提取所能获得的量极其有限,而化学合成成本高、耗资大。因此,寻求一种能稳定表达人源性蛋白并容易回收的真核表达体系获得更多的具有生物活性的hBD2是基因工程技术研究的主要目标之一。本试验在获得hBD2基因并构建其真核表达载体的基础上,用磷酸钙共沉淀法将重组质粒转染L929细胞,检测hBD2在L929细胞中的表达及体外抗菌活性。从而为hBD2进行临床抗感染治疗提供实验依据。
1 材料与方法 1.1 材料(1)人体组织:宫颈癌患者新鲜肿瘤组织(兰州大学第一医院妇产科);(2)载体:pGEM-TEasy载体(美国Promega公司):pCAGG表达载体(日本山形大学分子遗传学实验室馈赠);(3)菌种及细胞株:大肠埃希菌DH5、金黄色葡萄球菌(ATCC25923) 、铜绿假单胞菌(ATCC27853) 标准菌株、小鼠纤维母细胞株(L929)(本研究所保存);(4)试剂与仪器:限制性内切酶EcoRⅠ、dNTP、TaqDNA聚合酶、一步法RT-PCR试剂盒、琼脂糖(大连TaKaRa公司);5-滇-4氯-3-吲哚半乳糖苷X-gal、RNA提取试剂盒(美国Invitrogen公司);质粒提取试剂盒(美国OMEGA公司);焦碳酸二乙脂(DEPC)(美国Sigma公司);胶回收试剂盒(上海生工公司);1640培养基(美国GIBCO公司),胎牛血清(杭州四季青生物制品公司)。
1.2 方法 1.2.1 总RNA提取及RT-PCR取人新鲜宫颈癌组织约100mg,按RNA提取试剂盒操作说明进行RNA提取,以P1:53TGAAGCTCCCAGCCATCAGCCATP2:53TGGACACCATAGTTTAATTTGG为引物(产物长311bp,大连TaKaRa公司合成),按以下条件进行RT-PCR反应:50℃反转录30min,94℃预变性2min,然后进行35个PCR循环,94℃变性30s,56℃退火30s,72℃延伸45s,最后72℃延伸5min。
1.2.2 -防御素-2基因cDNA克隆及鉴定用胶回收试剂盒对RT-PCR扩增产物进行纯化回收,然后用T4-DNA连接酶将hBD2基因cDNA片段与pGEM-TEasy载体连接,连接反应物转化DH5感受态细胞, 挑选阳性菌落提取质粒。重组质粒的鉴定方法为:(1)对重组质粒作酶切鉴定;(2)以重组质粒为模板,用引物P1、P2作 PCR鉴定;(3)用APIPRISM3730DNA自动测序仪作插入片段序列测定予以确证。
1.2.3 真核表达载体pCAGG-hBD2构建及鉴定将测序正确的质粒pGEM-TEasy-hBD2和pCAGG分别进行双酶切,琼脂糖电泳后胶回收目的基因片段和去磷酸后的pCAGG大片段。将二者用T4DNA连接酶在16℃连接1h,连接产物转化DH5感受态细胞,37℃培养过夜。挑取单菌落,液体培养,提取质粒进行PCR检测和酶切检测,并进行DNA测序鉴定。
1.2.4 细胞培养及基因转染L929细胞采用RPMI1640加10%热灭活胎牛血清完全培养基培养,将细胞接种于60mm聚苯乙烯培养皿中,37℃、5%的CO2孵育箱内培养。待细胞融合,覆盖70%培养皿时进行基因转染,采用磷酸钙共沉淀法转染L929细胞,将pCAGG-hBD2、CaCl2、无菌去离子水、2N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES)缓冲液加入试管中,置室温30min,制成DNA-磷酸钙沉淀物。弃去细胞培养瓶内液体,将DNA-磷酸钙沉淀物吹打混匀后,缓慢加入60mm培养皿中,置室温30min,加入3ml含10%胎牛血清PRMI1640培养液,5%CO2在37℃条件下反应4h,去除培养液及沉淀物,加入2.5ml磷酸缓冲液(PBS)洗涤1次,去除PBS,加入3ml含10%胎牛血清的培养基,置37℃、CO2培养箱中继续培养24~48h。
1.2.5 转染细胞hBD2基因mRNA表达鉴定按RNA提取试剂盒操作说明提取转染细胞总RNA,以P1、P2为引物,用同上条件进行RT-PCR,反应产物用凝胶电泳检测、拍照。
1.2.6 抗菌活性检测pCAGG-hBD2转染24h后,将细胞培养液换成无抗生素、无血清的1640培养液培养,取细胞培养上清,转染空载体pCAGG和没有转染的细胞作为对照,将灭菌6mm滤纸片放入上述液体中浸泡12h备用。采用Kirby-Bauer纸片扩散法检测重组hBD2的抗菌活性,将浓度为105/ml的金黄色葡萄球菌和铜绿假单胞菌标准菌株分别涂布到细菌培养平板,待平板表面稍干后放置上述制备的含不同干预液的滤纸。37℃过夜孵育, 次日观察和记录抑菌环大小。
2 结果 2.1 RT-PCR扩增人-防御素-2cDNA(图 1)提取人宫颈癌组织总RNA, 进行RT-PCR扩增, 扩增产物在1.5%的琼脂糖凝胶上电泳, 可见约300bp单一条带。

|
注: 1: DNA 标志; 2: RT - PCR 产物。 图 1 人宫颈癌组织hBD2- mRNA |
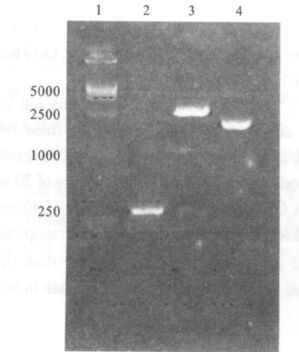
2.2 hBD2基因克隆重组体筛选与鉴定(图 2)
pGEM-TEasy载体具有Ampr抗性基因, 其多克隆位点在LacZ基因编码区内, 通过-互补原理, 可进行蓝白菌落筛选。连接产物转化大肠埃希菌DH5后, 在氨卞青霉素和异丙茎硫代--D半乳糖苷(IPTG)及X-gal的选择平板上, 挑选白色菌落, 提取质粒, 限制性内切酶EcoRⅠ酶切图谱分析证实, 含有插入的目的片段。以重组质粒为模板行PCR扩增,结果显示得到的基因片段与目的片段大小相符(图 2)。再经DNA序列测定, 所获得的PCR产物为预期的hBD2序列。
|
注: 1: DNA 标志; 2: pGEM- T Easy- hBD2 的hBD2 PCR 产物; 3: pGEM - T Easy- hBD2/ EcoR I; 4: pGEM- T Easy- hBD2。 图 2 克隆载体PGRM- T Easy- hBD2 的酶切鉴定 |
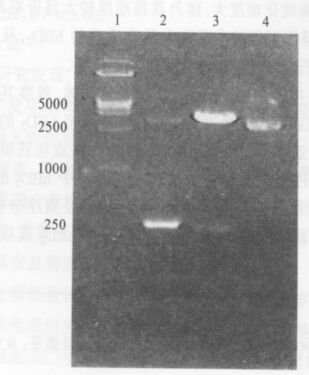
2.3 表达载体pCAGG-hBD2的鉴定结果(图 3)
重组质粒pCAGG-hBD2采用限制性内切酶EcoRⅠ酶切进行鉴定,结果获得了与克隆前产物同样大小的片段;以重组质粒pCAGG-hBD2为模板行PCR扩增,结果显示得到的基因片段与目的片段大小相符。经DNA序列测定, 确证该片段为hBD2编码序列,并且目的基因插入方向正确。
|
注: 1: DNA 标志; 2: 转染L929 细胞hBD2 PCR 产物; 转染空载体pCAGG 的L929 细胞; 4: 未转染的L929 细胞。 图 3 表达载体pCAGG- hBD2 的酶切鉴定 |
2.4 转染细胞hBD2基因mRNA表达鉴定(图 4)
以pCAGG-hBD2转染后L929的总RNA为模板, 进行RT-PCR反应, 可扩增出约300bp的目的条带, 而以转染空载体pCAGG和正常L929的总RNA为模板, 则不能扩增出阳性条带。上述结果显示, 我们构建的表达载体pCAGG-hBD2转染L929后, 可正确表达hBD2。

|
注: 1: DNA 标志; 2: pCAGG- hBD2 的hBD2 PCR 产物; 3: pCAGG- hBD2/ EcoR I; 4: pCAGG- hBD2。 图 4 转染细胞hBD2 mRNA 表达 |
2.5 重组hBD2抗菌活性测定
检测结果显示转染pCAGG-hBD2细胞的上清液对金黄色葡萄球菌、铜绿假单胞菌均可形成抑菌环, 直径平均值分别为19,17mm, 而转染空载体pCAGG和没有转染的细胞上清液并无阳性抑菌环形成(<10mm均认定为阴性)。
3 讨论hBD2在正常人皮肤、肺部、呼吸道、角膜上皮、泌尿生殖道、口腔角化细胞及胃肠上皮细胞等均有微量表达[1]。一旦使这些部位受到炎性刺激时, hBD2则大量表达发挥作用。hBD2具有广谱高效的抗微生物活性[4-5], 对革兰阳性菌、革兰阴性菌、真菌、螺旋体和病毒均有杀伤作用。研究表明,hBD2还可以上调机体对微生物入侵的天然防御功能[6]。正是由于hBD2在对抗微生物中的显著作用, 使其显示了良好的应用前景。由于hBD2在人体和哺乳类动物正常组织中含量很少,分离纯化难度大,体外获得难度较大且价格昂贵[7]。因此通过基因工程技术获取大量有活性的hBD2,从而为应用hBD2进行临床抗感染治疗提供实验依据。
本实验构建hBD2基因的真核表达载体,观察其转染哺乳动物细胞后可否正确表达hBD2,并对重组hBD2的抗菌活性进行初步观察。本研究用RT-PCR方法成功获得了目的cDNA,并经序列分析与基因库(GeneBank)中hBD2的cDNA序列完全一致。表达载体pCAGG-hBD2经测序分析, 证实目的基因片段插入正确,说明成功构建了hBD2真核表达载体。抗菌活性实验的结果显示,转染pCAGG-hBD2细胞的上清液对金黄色葡萄球菌、铜绿假单胞菌均有杀灭活性,但最小抑菌浓度有待进一步研究。结果表明,用新构建的pCAGG-hBD2质粒转染L929细胞是可行的。
| [1] | Isomot o H, Mukae H, Ishmot o H, et al. High concent rat ions of human beta-defensin 2 in gast ric juice of pat ient s w ith Hel icobact er pylori infection[J]. World J Gast roent etrol, 2005, 11(31) : 4782–4787. DOI:10.3748/wjg.v11.i31.4782 |
| [2] | 李萍, 景涛. 黄芪多糖对大鼠B-防御素基因表达的调节作用[J]. 中国公共卫生, 2004, 20(11) : 1375–1376. |
| [3] | 李萍, 陈新年, 景涛. 结核杆菌感染对人肺组织B-防御素的作用[J]. 中国公共卫生, 2003, 19(12) : 1464–1466. |
| [4] | Harder J, Bartels J, Christophers E. A pept ide ant ibiot ic from skin[J]. Nature, 1997, 387 : 861. DOI:10.1038/43088 |
| [5] | Tsut sum iv-Ish ò Y, Nagaoka iv. NF-kappa B-mediat ed transcriptional regulat ion of human bet a-defensin-2 gene follow ing lipopolysaccharide st imulation[J]. J Leukoc Biol, 2002, 71(1) : 154–162. |
| [6] | Hiemst rap S, Fern IE-Kngba, Mcmichael J, et al. Ant imicrobial pept ides: mediat ors of innat e immunity as templates for the development of novel ant i-infective and immune therapeut ics[J]. Curr Pharm Des, 2004, 10(23) : 2891–2905. DOI:10.2174/1381612043383566 |
| [7] | 李楠, 肖桃元, 粟永萍, 等. 重组人B-防御素2 在真皮多能干细胞中的表达及抗菌活性的测定[J]. 第三军医大学学报, 2006, 28(4) : 284–286. |
 2007, Vol. 23
2007, Vol. 23
