2. 黑龙江中医药大学附属第一医院妇产科
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是女性常见的生殖功能障碍疾病,表现为高雄激素血症、卵泡发育障碍和卵巢无排卵。在育龄妇女中患病率为5%~10%,约占不育症门诊患者的50%~70%[1]。目前认为,PCOS患者卵巢形态学改变导致雄激素合成增多,而缺乏关于卵巢形态学改变对雌激素合成影响的研究。近年来发现,临床上部分患者属于不典型的PCOS,我们定义为功能性卵巢高雄(functional ovarian hyperandrogenism,FOH)。本研究通过对FOH患者雌激素合成的研究,探讨卵巢形态学改变和雌激素代谢之间的关系,以探讨PCOS的病理生理机制。
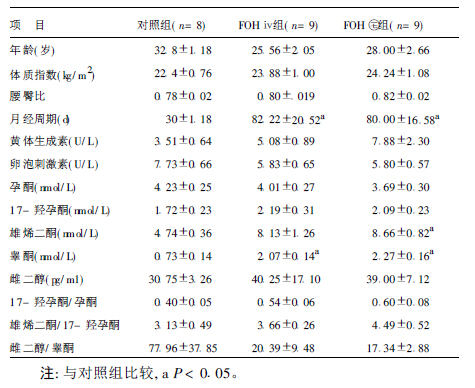
1 对象与方法 1.1 对象选择2002年5~12月在南京大学医学院临床学院,南京军区南京总医院妇产科门诊就诊的患者18人为研究对象,年龄20~35岁,平均年龄25.4岁。根据2~8mm的小卵泡数量分组,双侧小卵泡数量为8~11的9人为FOH ⅳ 组,双侧小卵泡数量为12~24的9人为FOH II组。随机选取南京军区总医院妇产科女医生和研究生8人作为对照组,年龄25~35岁,平均年龄27.6岁,具有规律的月经周期,经直肠超声检查卵巢形态学均正常。所有入选对象血清硫酸脱氢表雄酮水平正常(<5µmol/L),无肝、肾功能损害,并排除甲状腺、肾上腺疾病利和高泌乳素血症等其他内分泌疾病,且2个月内未使用过激素类药物。
1.2 诊断标准PCOS诊断标准:(1)具有月经异常(稀发、闭经)、不孕、痤疮和多毛等临床表现;(2)月经第3~5d或闭经期(B超未见φ>10mm的卵泡)血睾酮升高(≥2.2nmol/L)或雄烯二酮升高(≥6nmol/L);(3)经直肠超声检查卵巢形态学为多囊改变,表现在卵泡数量上,每侧卵巢φ2~8mm的卵泡数量≥12[2]。FOH的诊断标准为符合(1)和(2)且卵巢形态学改变未达到(3)[3]。
1.3 方法分别对每个患者记录身高、体重、腰围和臀围及检测PCOS相关的临床指标。在自然或人工(黄体酮注射液20mg 肌注1d,持续5d)月经周期第2~5d,肌肉注射人绝经期促性腺激素150U(丽珠集团丽宝生物化学制药有限公司)、毛绒毛膜促性腺激素促性腺激素5000U(上海第一生化药业有限公司)行卵巢兴奋试验。用药前(H0)及用药后3,8,12,18和24h采静脉血,共6次,室温静置30min,3000r/min离心,取血清,-70℃保存备用。应用化学发光酶免疫技术测定血清中睾酮(testosterone,T)和雌二醇(estradiol,E2)浓度,仪器为Access全自动微粒子酶放大化学发光免疫分析系统(美国Beclunarl公司),试剂盒为其专用试剂。批内、批间变异系数<10%。
1.4 甾体激素代谢指标芳香化酶功能状态等于各时点雌二醇浓度/睾酮浓度(E2/T);酶功能活性等于各点激素浓度减去基础值后,除以底物浓度所得的值[(E2Hi-E2H0)/E],代表单位时间内酶催化底物生成产物的能力,酶的功能状态和功能活性结合,是评价各种性激素合成酶的功能指标的2个方面。
1.5 统计分析采用SPSS 11.0软件进行方差分析和经过Bonferroni修正的协方差分析,协变量采用相应的基础值;相关分析采用Spearman法。
2 结 果 2.1 一般状况及基础激素测定(表 1)(1)3组妇女的体质指数、腰臀比及年龄差异无统计学意义,可以排除体质指数、腰臀比及年龄因素对统计结果的影响,FOH ⅳ 组和FOH II组的月经周期均显著大于对照组。(2)3组黄体生成素、卵泡刺激素及促甲状腺激素比较差异无统计学意义。(3)3组孕酮、17-羟孕酮、17-羟孕酮/孕酮、雄烯二酮/17-羟孕酮、雌二醇比较差异无统计学意义。FOH II组雄烯二酮浓度显著高于对照组,FOH ⅳ 及FOH II组睾酮浓度显著高于对照组。
| 表 1 3 组妇女一般状况和基础激素测定结果( x±s) |
2.2 卵巢兴奋试验后E2浓度测定(表 2)
3组E2变化趋势相似,峰值均出现于12h时点,各时点浓度FOH II组>FOH ⅳ 组>对照组,其中3h时点E2浓度FOH ⅳ 和FOH II组均显著高于对照组,8,12,18,24h时点E2浓度FOH II组显著高于对照组利FOH ⅳ 组。
| 表 2 各组妇女各时点血清E2( pg/ ml) 均数估计结果( x±s) |
2.3 芳香化酶功能状态
3组芳香化酶功能状态变化趋势相似,各时点间差异无统计学意义。
2.4 芳香化酶功能活性3组芳香化酶功能活性变化趋势相似,各时点芳香化酶功能活性值FOH ⅳ >FOH II组>对照组,但差异无统计学意义。
3 讨 论PCOS诊断标准一直存在着分歧,欧美学者于2003年在Rotterdam会议提出统一的诊断标准[2],新的诊断标准强调了卵巢多囊性改变,体现在卵巢数量上,主要是单侧卵巢φ2~8mm的卵泡数量≥12,增加的小卵泡数量与PCOS的甾体激素合成之间存在着密切的联系。本研究选取双侧φ2~8mm卵泡数量未达到典型多囊改变,但符合其他2项诊断指标的非典型PCOS患者,定义为功能性卵巢高雄(FOH),研究雄激素和卵泡数量对雌激素合成的影响。卵巢兴奋试验后3h,FOH ⅳ E2浓度显著高于对照组,提示较多的底物雄激素促进了卵巢兴奋试验后E2的合成。卵巢兴奋试验后8后的4个时点中,FOH II组E2浓度均显著高于FOH ⅳ 组和对照组,提示在相同的高雄激素水平下,卵泡数量的增加也明显促进了卵巢兴奋试验后E2的合成。研究结果表明,高雄激素血症和卵泡数量增多均能促进卵巢兴奋试验后E2的合成,2者具有协同作用。
芳香化酶是雄激素转化为雌激素的关键酶[4]。近年来,对卵泡液测定和卵泡颗粒细胞合成E2的研究发现,PCOS无排卵患者小卵泡内源性的芳香化酶活性无缺陷[5],这与本研究结果相符;FOH ⅳ 组和FOH II组芳香化酶功能状态及功能活性与对照组比较差异均无统计学意义。在正常的芳香化酶活性基础上,增加的卵泡数量则为雌激素的合成增加了储备,在促排卵时,相似的促性腺激素用量可以引起较高的E2合成量[6]。随年龄增长,卵巢老化和卵泡丢失加速,使PCOS及FOH这种病理高功能状态逆转,雌激素合成降低[7]。
| [1] | 王勇, 朱雅男, 吴效科. 多囊卵巢综合征发病的遗传学研究进展[J]. 中华医学杂志, 2004, 84(10) : 1–6. |
| [2] | The Rot t erdam ESH RE/ ASRM - S ponsored PCOS consensus w orkshop group. Revised 2003 consensus on diagnost ic criteria and long - t erm health risks relat ed t o polycyst ic ovary syndrom e ( PCOS)[J]. Hum Reprod, 2004, 19(1) : 41–47. DOI:10.1093/humrep/deh098 |
| [3] | Escobar- Morreale H F, Luque- Ramirez M, San Millan JL. Th e molecular- gen etic basis of funct ional hyperandrogenism and th e polycyst ic ovary syndrome[J]. Endocr Rev, 2005, 26(2) : 251–282. DOI:10.1210/er.2004-0004 |
| [4] | 王勇, 范海健, 吴效科, 等. 芳香化酶基因中相连多态性位点的频 率分布[J]. 中国公共卫生, 2005, 21(5) : 539–540. |
| [5] | Mason H, Franks S. Local control of ovarian steroidogenesis[J]. Baillieres Clin Obst et Gynaecol, 1997, 11(2) : 261–279. DOI:10.1016/S0950-3552(97)80037-5 |
| [6] | Mason HD, Margara R, Winst on RM, et al. Insulin - like grow th fact or- ? ( IGF- ? ) inhibit s product ion of IGF- binding prot ein - 1 w hile st imulat ing estradiol secret ion in granulosa cells f rom normal and polycyst ic human ovaries[J]. J Clin Endocrinol Met ab, 1993, 76(5) : 1275–1279. |
| [7] | Elt ing MW, Kw ee J, Korsen TJ, et al. Aging women w ith polycyst ic ovary syndrome w ho ach ieve regular menst rual cycles have a smaller follicle cohort than those w ho cont inue t o have irregular cycles[J]. Fert il St eril, 2003, 79(5) : 1154–1160. DOI:10.1016/S0015-0282(03)00152-3 |
 2007, Vol. 23
2007, Vol. 23