2. 中国疾病预防控制中心营养与食品安全所
2. 2
伏马菌素(fumonisin,FB)是近年来新发现的一组真菌毒素[1],到目前为止,发现的FB有11种,其中FB1是污染玉米的主要成分,也是导致毒性作用的主要原因。研究证明,FB1可引起马脑白质软化病(ELEM)和猪肺水肿综合征(PPE)。流行病学资料显示,人类膳食中FB1污染与食管癌高发有一定关联。国际癌症研究中心把FB划分到2B组,即人类可能的致癌物。用于分析粮食中的FB1的仪器方法虽具较高的灵敏度和特异性,但需复杂的提纯净化步骤和较贵重的仪器设备,不易推广使用[2]。而应用单克隆抗体或多克隆抗体的酶联免疫吸附试验(ELISA)检测方法,则具备简单、快速、灵敏的特点,并可同时检测大量样品。国外报道有抗FB1的ELISA试剂盒,但价格昂贵。本研究研制了具有我国自主知识产权的FB1 ELISA试剂盒,可为我国进行玉米及玉米制品中FB1的污染情况调查及制定国标FB1建议值等提供技术支持。
1 材料与方法 1.1 材料 1.1.1 器材及试剂CO2培养箱(美国Queue公司);超净工作台(北京半导体设备一厂);酶标分析仪(美国SUNRISE公司);电子分析天平(瑞士Mettler公司);低温高速离心机(德国Hermle公司);电泳仪(美国BIO-RAD公司);酶标板(96孔,美国Corning公司)等。伏马菌素B1(fumonisin,FB1)、抗体亚类测定试剂盒(美国Sigma公司);RPMI1640培养基、HEPES、福氏佐剂、二甲基亚砜等(美国Gibco公司);辣根过氧化物酶标记的羊抗鼠IgG免疫球蛋白(北京中山生物技术有限公司);实验所用其他试剂均为分析纯以上(北京化学试剂公司);玉米盲样(美国VICAM公司)。
1.1.2 溶液系统(1)包被液:0.05mol/L磷酸盐缓冲液(PBS),pH 9.6。(2)洗涤液:PBS-T,即含0.05%Tween20的0.01mol/L磷酸盐缓冲液(PBS)(V/V)。(3)底物缓冲液:0.1mol/L柠檬酸加0.2mol/L磷酸氢二钠,pH5.0。(4)底物溶液:10mg 3 3'5 5'-四甲基联苯胺加入1ml二甲基甲酰胺,冷冻保藏。用时取此溶液75µl,加10ml底物缓冲液和10µl H2O2。(5)终止液:2mol/L H2SO4。(6)抗体稀释液:含0.1%(w/v)小牛血清白蛋白(BSA)的0.05mol/L PBS。(7)酶标二抗:1:5000辣根过氧化物酶标记的羊抗鼠IgG免疫球蛋白。(8)抗体:1:3.0×106抗FB1单克隆抗体。(9)FB1标准溶液:将FB1溶于乙腈水(V:V,50:50)中,配成1mg/ml作为储备液,4℃保存。ELISA校正曲线使用的1.0~2000.0ng/ml标准液由上述溶液用甲醇-PBS(v:v,10:90)新鲜配制。
1.1.3 单克隆抗体的制备、纯化及鉴定分泌抗FB1毒素单克隆抗体的杂交瘤细胞株由本室建立。BALB/c小鼠购自军事医学科学院实验动物研究所动物繁育场。采用动物体内诱生单克隆抗体的方法制备抗体。采用饱和硫酸铵法对腹水进行纯化[5]。抗体的免疫球蛋白类别及亚类鉴定采用抗体亚类测定试剂盒。抗体蛋白含量采用BCA蛋白分析试剂盒进行测定。抗体分子量采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)法[6]。抗体亲和力的测定采用间接非竞争性ELISA法[7]。抗体的特异性和抗体的灵敏度测定采用间接竞争抑制性ELISA法。
1.2 方法 1.2.1 样品提取研磨玉米使其90%可通过250~500µm网筛。称取5g加到100ml具塞三角烧瓶中,加入1.25g NaCl及25ml甲醇水溶液(v:v,80:20),强力震荡3min,经滤纸过滤。滤液用1%NaCl稀释10倍进行检测。
1.2.2 检测步骤(1)用FB1-BSA(0.125µg/ml)包被酶标微孔板,每孔120µl,4'℃过夜;(2)包被好的酶标板用PBS-T洗1×3min后,用0.2%BSA封闭,每孔200µl,4℃过夜;(3)酶标板用PBS-T洗3×3min后,加入不同浓度的标准溶液或样品提取液和单克隆抗体溶液的混合液100µl(该混合液为FB1毒素标准液或样品提取液与单克隆抗体溶液按1:1比例混合),37℃,90min;(4)酶标板用PBS-T洗3×3min后,加入酶标二抗,每孔100µl,37℃,50min;(5)酶标板用PBS-T洗5×3min后,加入底物溶液,每孔100µl,37℃,15min;(6)加入终止液,每孔50µl,于450nm处测定吸光度(A)值。(7) 计算公式:样品中FB1含量(ng/g)=CDX/W。式中:C-酶标板上测的FB1浓度(ng/ml),根据标准曲线求得;D-样品提取液的体积,ml;X-稀释倍数;W-样品重量,g;按上述操作步骤,5g样品加入25ml提取液,则公式可写成:样品中FB1含量(ng/g)=5CX。
1.2.3 试剂盒各项技术参数的研究(1)检出限(灵敏度)和专一性(特异性):同抗体的特性鉴定。(2)稳定性试验:采用37℃加速破坏实验进行研究。将试剂盒放置于37℃,每隔24h进行ELISA测定,测定阴性对照(不加毒素设为B0)和阳性(即50%的抑制毒素浓度设为B)的A值,计算两者的比值AB/AB0。当AB0<0.6,或AB/AB0>0.7时,即可判定ELISA试剂盒已失效。37℃下的24h相当于常温下的45d。(3)回收率试验:做3个水平(根据试剂盒的检测范围确定加标浓度)、6个重复的回收率试验。回收率(%)=[新样品(加标)测定值-原样品测定值]/已知加标量×100%。(4)方法的重复性:即实验室内的变异程度,对3个水平6个重复的回收率测试的结果进行变异系数的计算。(5)方法的再现性:即实验室间的变异程度,3个实验室分别做3个水平6个平行样品回收率测试实验,计算实验室间的变异系数。(6)试剂盒与高效液相色谱(HPLC)方法验证:使用该试剂盒对FB1玉米盲样进行检测,并同时用HPLC方法进行验证。
2 结 果 2.1 单克隆抗体特性的鉴定抗体的亚类为IgG1、分子量150KD、杂交瘤细胞产生的腹水稀释度为1:2.0×108、亲和常数为6.72×109L/mol。FB1的最低检出浓度为5ng/ml,校正曲线的线性范围50~500ng/ml,线性方程Y=-0.582X+1.793(r=0.99,P<0.05)。
2.2 试剂盒特性研究(1)灵敏度和特异性:最低检出浓度为51ng/ml,样品的最低检出量为250ng/g。与参试毒素脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)、T-2毒素(T-2 toxin)均无交叉反应,特异性较好。(2)稳定性:连续7d的稳定性实验结果显示,37℃第6d的B/B0值>0.7,因37℃下的24h相当于常温下的45d,试剂盒在常温状态有效期可保持225d(7.5个月)。ELISA板的条间变异系数为3.94%,行间变异系数为0.73%,总变异系数为5.78%,均符合试剂盒的要求(条件变异系数<10%,总变异系数<20%)。(3)回收率测定:进行50,200和500ng/ml 3个加标浓度的回收率实验,回收率在71.89%~112.95%之间,平均回收率为100.23%,变异系数为14.21%。(4)重复性:3个加标浓度的回收率的变异系数分别6.02%,12.97%和6.88%。结果显示,本试剂盒重复性较好。(5)再现性:3个实验室所进行的50,200,500ng/ml 3个加标浓度6个平行样品的检测结果显示,变异系数分别为15.51%,16.73%,9.76%。
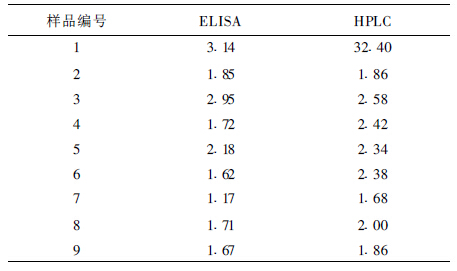
2.3 与HPLC方法验证(表 1)分别使用试剂盒(ELISA)和HPLC方法对盲样进行检测。2种方法检测结果差异无统计学意义(P>0.05)。
| 表 1 样品不同方法检测结果(µg/g) |
3 讨 论
自从1988年Gelderblom等首次发现并分离出FB以来,FB1广泛受到各国政府和学者的关注,已成为继黄曲霉毒素后的又一真菌毒素研究热点。世界范围污染调查显示,玉米污染FB1的状况十分严重。我国迄今为止还没有开展过全国性的粮食中FB1污染状况调查。国内外学者主要是针对我国食管癌高发区进行的污染调查。结果显示,我国食管癌高发区的玉米中FB污染状况很严重,但尚不能代表全国的污染状况。研制具有我国自主知识产权的FB1ELISA检测试剂盒,对开展全国性FB污染调查及制定粮食中推荐限量标准建议值具有重要意义。本文在获得抗FB1单克隆抗体的基础上,研制的FB1的间接竞争抑制性ELISA检测试剂盒,其最低检出浓度为5ng/ml,样品的最低检出量为250ng/g,可以与国外同类试剂盒灵敏度相媲美。因无法得到FB2、FB3等FB各亚类纯品,故无法进行各亚类之间交叉反应实验,只进行了与镰刀菌属的霉菌产生的DON、ZEN、T-2毒素的交叉反应,结果显示,与之均无交叉反应,特异性较好。该试剂盒回收率在71.89%~112.95%之间,并通过实验室内、实验室间及仪器法验证。可在常温状态下保存225d,适合基层单位和现场筛查使用。
| [1] | Gelderblom WCA, Marasas WFO. Cancer promoting pot ent ial of diff erent st rains of Fusarium moniliforme in a short t erm cancer initiat ion promot ion assay[J]. Carcinogenesis, 1988, 9 : 1405–1409. DOI:10.1093/carcin/9.8.1405 |
| [2] | GS Sh ephard. Chromatographyic det erminat ion of the fumonisin mycot oxins[J]. Journal Chromatography A, 1998, 815 : 31–39. DOI:10.1016/S0021-9673(98)00187-3 |
| [3] | Azcona Olivera JI, Abouzied MM. Product ion of monoclonal ant-i bodies to the fumonisins B1, B2 and B3[J]. Agric Food Ch em, 1992, 40 : 531–534. DOI:10.1021/jf00015a034 |
| [4] | Az cona Olivera J I, Abouzied MM. Generat ion of antibodies react ive w ith fumonisins B1, B2 and B3 by using cholera toxin as the carrier - adjuvant[J]. Appl Environ Microbiol, 1992, 58(1) : 169–173. |
| [5] | 徐志凯. 实用单克隆抗体技术[M]. 西安: 陕西科学技术出版社, 1992: 75-89. |
| [6] | J 萨姆布鲁克, E F 弗里奇, T 曼尼阿蒂斯. 分子克隆实验指南[M].北京: 科学技术出版社, 1996: 880-887. |
| [7] | 万文徽. 单克隆抗体亲和常数的测定[J]. 单克隆抗体通讯, 1993, 9(2) : 72–75. |
 2007, Vol. 23
2007, Vol. 23

 , 杨军1, 江涛2, 李凤琴2, 韩春卉2
, 杨军1, 江涛2, 李凤琴2, 韩春卉2