2. 山东师范大学生命科学学院;
3. 山东大学毒理学研究所
二十二碳六烯酸(docosahexaenoic acid,DHA)复合物是山东大学毒理学研究所研制的一种以DHA为主要成分的复方抗癌新药,体内及体外对多种癌细胞具有明显的杀伤作用,抗癌机制尚不清楚[1-4]。酪氨酸蛋白激酶(tyrosine protein kinase TPK)在细胞生长、增殖、分化、转化等过程中起着重要的调节作用,并与肿瘤的发生密切相关。我们用[γ-32P]三磷酸腺苷(adenosine triphosphate;ATP)作为反应启动剂掺入外源性底物的方法测定TPK活性,研究DHA复合物对H22癌细胞内TPK活性的影响,从而探索其抗癌机制。
1 材料与方法 1.1 材料 1.1.1 动物清洁级小鼠50只,昆明种,18~22g,雄雄各半(山东大学实验动物中心)。
1.1.2 瘤株小鼠H22肝癌细胞株(山东省医学科学院药物所)。
1.1.3 药物与试剂DHA复合物由本室自行研制,用0.5%羟甲基纤维素钠配制,现用现配。多聚氨基酸(谷氨酸∶丙氨酸∶酪氨酸=4∶1∶1),Polu(Glu∶Ala∶Tyr=4∶1∶1)(美国Sigma公司);[γ-32P]ATP(北京福瑞生物制品公司)。其他试剂为国产或进口分析纯。
1.2 方法 1.2.1 抑瘤率取H22癌细胞种鼠,腹部消毒后,抽取腹水,分离H22癌细胞,制成浓度为1.0×107/ml的细胞悬液,台盼蓝染色检查细胞活性,成活率95%以上即可接种。于每只小鼠左腋窝下接种0.2ml,整个操作过程30min内完成。24h后,将小鼠随机分成4组,每组10只,溶剂对照组灌服羟甲基纤维素钠125mg/kg,DHA复合物高、中、低剂量组分别灌服DHA复合物55.0,37.5,20.0mg/kg,每日1次,连续10d,停药24h,处死小鼠,解剖剥离瘤组织称重。另设正常对照组,10只小鼠。按以下公式计算抑瘤率。
抑瘤率(%)=
Lowry法测定蛋白含量[7]。
1.2.4 TPK活性的测定按改良的Kong和Wang氏法[8]。每50µl酶反应液[20mmol/L Tris-HCl pH7.5,50mmol/L MgCl2,10mmol/L,MnCl2,2.5mmol/L Na3VO\-4,7mg/ml对硝基苯磷酸(PNPP),2mmol/L三氟吡啦嗪(TFP),4mg/ml [Poly(glu∶Ala∶Tyr=4∶1∶1]300µmol/L [γ-32P]ATP(含0.5µCi)]中加入3µg酶蛋白,加[γ-32P]ATP启动反应,30℃,准确反应5min,加10%预冷的三氯乙酸3ml终止反应,然后抽滤至玻璃纤维素膜上,分别以预冷5%三氯乙酸,预冷的无水乙醇各洗涤一次,待干燥后将玻璃纤维素膜放入闪烁瓶里,加入5ml闪烁液,2h后,以Bckmannals3801液闪记数仪测定其放射性强度。
1.3 统计分析用Stata软件进行统计学处理,多个实验组与对照组的比较用最小显著差(LDS)法(单侧检验)。
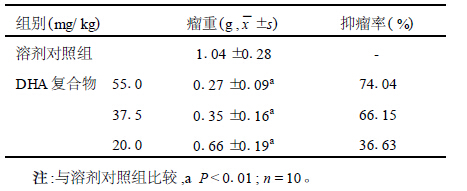
2 结 果 2.1 抑瘤率(表 1)溶剂对照组肿瘤平均重量1.0g,DHA复合物实验组平均瘤重均小于溶剂对照组,差异有统计学意义(55.0,37.5,20.0mg/kg组t值分别为8.939,8.010,4.411,P值均为0.000),且抑瘤率均>30%,表明DHA复合物在体内有明显的抑瘤作用。表 1 DHA复合物对H22癌细胞的抑制作用
| 表 1 DHA复合物对H22癌细胞的抑制作用 |
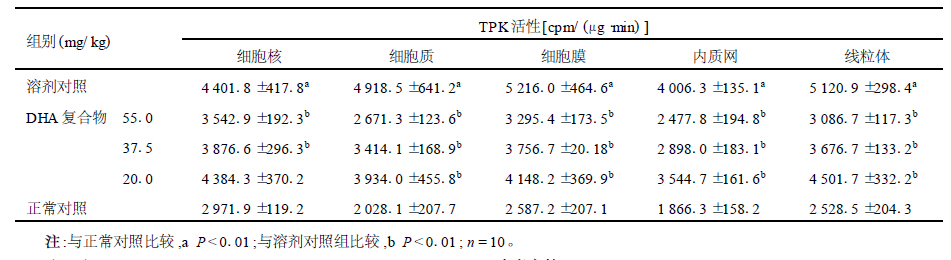
2.2 TPK活性(表 2)
| 表 2 DHA复合物对H22癌细胞各亚细胞成分TPK活性的影响( x ±s) |
癌细胞细胞核、细胞质、细胞膜、内质肉和线粒体中TPK的活性与正常对照组比较,差异有统计学意义(t分别为10.651,21.162,25.412,28.573,24.849,P值均为0.000)。给予DHA复合物作用后,癌细胞上述各组分中TPK的活性与溶剂对照组比较,差异有统计学意义(细胞核55.0,37.5,20.0mg/kg组t分别为6.532.912,0.130,P分别为0.000,0.002,0.448;细胞质5560,37.5,20.0mg/kg组t值分别为16.451,11.011,4.825,P值为0.000;细胞膜55.0,37.5,20.0mg/kg组t值分别为18.569,10.312,7.543,P值均为0.000;内质网55.0,37.5,20.0mg/kg组t值分别为20.415,14.794,6.169,P值均为0.000),表明H22癌细胞上述各组分中TPK的活性普遍升高,而DHA复合物可显著降低癌细胞TPK活性。
3 讨 论酪氨酸蛋白激酶(TPK)是催化蛋白质酪氨酸残基磷酸化反应的酶,活化后的TPK可诱导产生多种细胞内效应,包括离子流、产生第二信使及多蛋白的磷酸化。TPK的过度活化将导致整个细胞信号传导处于高活性状态,引起细胞骨架受损,细胞形态与功能异常,细胞持续增殖、恶变,导致肿瘤发生。
本实验结果显示,H22癌细胞中,细胞核、细胞质、细胞膜、内质网及线粒体中的TPK活性均明显升高,且差异有统计学意,提示TPK活性异常可能是H22癌细胞无限增殖的一个重要原因。经DHA复合物作用后,H22癌细胞各亚细胞成分中的TPK活性均显著降低,且随DHA复合物剂量的增加,TPK活性降低越明显,呈明显的剂量-反应关系,其中高剂量组各亚细胞成分中TPK活性已降低至接近正常水平。表明DHA复合物可通过抑制TPK的活性,降低细胞内的信号传递,使细胞生长增殖受到抑制,从而达到抑制肿瘤的目的。
| [1] | 赵丽, 孙克任, 侯雪云, 等. DHA 复合物抑癌作用的实验研究[J]. 中国海洋药物, 2003, 22(1) : 30–32. |
| [2] | 赵丽, 孙克任, 鲍蕾, 等. DHA 复合物对鼠移植瘤细胞和T 淋巴 细胞细胞周期及凋亡的影响[J]. 肿瘤, 2004, 24(3) : 223–225. |
| [3] | 赵丽, 孙克任, 李慧, 等. DHA 复合物抑瘤作用的电镜观察[J]. 中国海洋药物, 2004, 23(1) : 26–29. |
| [4] | 马栋柱, 孙克任, 赵丽, 等. 药物AC288 的抗肿瘤作用和对荷瘤 小鼠T 细胞的Fas、NF2κB/ IκB 的影响[J]. 上海免疫学杂志, 2002, 22(4) : 246–249. |
| [5] | 苏拔贤. 生物化学制备技术[M]. 北京: 科学出版社, 1982: 155-158. |
| [6] | 韩锐. 抗癌药物研究与实验技术[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1997: 284-285. |
| [7] | Lowry OH, Rosebrough NJ, Farr AL, et al. Protein measurement with the Folin phenol reagent[J]. J Biol Chem, 1951, 193(1) : 265–275. |
| [8] | Kong SK, Wang J H. Purification and characterization of protein ty2 rosine kinase from bovine spleen[J]. J Biol Chem, 1987, 262(6) : 2597–2603. |
 2007, Vol. 23
2007, Vol. 23