2. 山东大学山东省立医院;
3. 美国辛辛那提大学辛辛那提儿童医院糖尿病中心
人类的1型糖尿病和非肥胖糖尿病(Non-obese diabetic,NOD)鼠均是T细胞介导的自身免疫性疾病[1, 2], 其发生是因为炎性细胞浸润胰岛引起胰岛炎,造成产生胰岛素的胰岛β细胞的进行性破坏和数量减少,胰岛素产生不足。浸润胰岛的炎性细胞包括CD4+T细胞、CD8+T细胞、B细胞、树突状细胞、巨噬细胞等。已有研究证实,1型糖尿病的发生既需要CD4+T细胞也需要CD8+T细胞[3-5], 但二者各自所起的作用尚不清楚。探讨胰岛炎性细胞浸润的启动是目前1型糖尿病研究的热点。本研究利用NOD背景的转基因小鼠,通过过继转移试验来观察CD8+T细胞在糖尿病发病中的作用。
1 材料与方法 1.1 材料 1.1.1 小鼠NOD/LTJ小鼠、BDC2.5 NOD.scid小鼠和NOD.scid小鼠[6, 7]和T细胞缺陷的NOD (NOD.scid) 小鼠[8](美国Jackson实验室)。NOD.scid.Rip.B7[8, 9], NOD.Ragnull.AI4α和NOD.Ragnull.AI4βTCR转基因鼠[10](美国Jackson实验室)。表达对β细胞抗原特异性的、H2Kd限制性TCR的NOD.Ragnull.AI4αβ转基因鼠由NOD.Ragnull.AI4α和NOD.Ragnull.AI4βTCR转基因鼠杂交而来。
1.1.2 试剂PE标记的CD4+特异性的单克隆抗体和FITC标记的Vβ4特异性的单克隆抗体 (美国Caltag公司),FITC标记的AI4 CD8+T细胞特异性抗体和PE标记的TCR Vα8.3特异性抗体 (美国BD Pharmingen公司)。
1.2 方法 1.2.1 脾细胞的分离[10, 11]将新鲜脾用2块灭菌载玻片的毛边将脾研磨碎, 4℃,400 g离心5 min, 弃上清;加红细胞裂解液2.5 ml/脾,混匀后立即4℃,400 g离心5 min,弃上清; 洗去红细胞裂解液,4℃,400 g离心5 min,去上清;用磷酸盐缓冲液 (PBS) 将白细胞充分悬浮,计数白细胞。
1.2.2 筛选小鼠基因型B7基因用聚合酶联反应的方法(PCR)确定阳性, scid和β2mnull用流式细胞分析的方法确定。
1.2.3 过继转移试验参照文献[7]进行。
1.2.4 流式细胞分析用Becton Dickinson FACScalibur流式细胞仪检测,运行CELLQuest软件(Becton Dickinson, San Jose, CA)采集数据,WinMDI 2.8软件进行分析。
1.2.5 糖尿病和胰岛炎的评估当连续2 d测定血糖均>16.7 mmol/L时评定为糖尿病,切除胰腺,用10%福尔马林液固定, 石蜡包埋,每间隔100 μm连续非重叠性切片并HE染色,评定胰岛炎。胰岛评分[12]:正常胰岛(无淋巴细胞侵润),胰岛外周炎(淋巴细胞浸润在胰岛周围),胰岛炎(淋巴细胞浸润至胰岛内)。
1.3 统计分析应用SPSS 11.0软件进行分析,用T Test方法进行统计分析,检验水平α=0.01。
2 结果 2.1 幼年NOD鼠体内致糖尿病性T细胞 (图 1)转移2周龄NOD鼠的脾细胞后11周100%的NOD.scid.Rip.B7鼠发生糖尿病,而在对照组 (NOD.scid组),即使转移脾细胞后20周仍然没有受体鼠发生糖尿病。在转移脾细胞后9周,当大部分NOD.scid.Rip.B7受体鼠发生糖尿病时,在NOD.scid受体鼠组尚没有检测到胰岛淋巴细胞浸润。并且,转移3周龄NOD鼠的脾细胞后2组均有糖尿病发生,但NOD.scid对照组的发病率(转移后9周时发病率13%)远低于NOD.scid.Rip.B7试验组的发病率(转移后9周时发病率100%)(P < 0.001)。
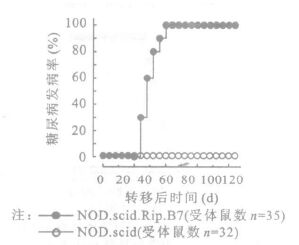
|
图 1 2周龄NOD鼠脾细胞诱导的糖尿病 |
2.2 β细胞上CD80的表达不影响CD4+T细胞的致糖尿病能力
静息的BDC2.5CD4+T细胞腹腔注射给6~8周龄NOD.scid.Rip.B7实验组和6~8周龄NOD.scid对照组后观察到的糖尿病发生率和特点相同,并且不同数量的BDC2.5 CD4+T细胞转移到NOD.scid.Rip.B7和NOD.scid受体鼠所诱导的糖尿病发生率及发病特点都相似。
2.3 β细胞上CD80的表达影响CD8+T细胞的致糖尿病能力将4周龄NOD.Ragnull.AI4 TCR转基因鼠的脾细胞腹腔注射至6~8周龄的NOD.scid.Rip.B7和年龄匹配的NOD.scid鼠,2组鼠均发生糖尿病,但发病特点却显著不同。所有NOD.scid.Rip.B7组在接受CD8+T细胞转移后24 d(图 2)和45 d(图 3)均发生显性糖尿病,但与所转移的T细胞数量有关。在NOD.scid对照组,只是在转移CD8+T细胞后100 d才有80%~100%的延迟发生症状明显的糖尿病。9~10 d NOD.Ragnull.AI4 TCR转基因鼠的脾细胞转移到NOD.scid.Rip.B7鼠,31 d后开始有受体鼠发生糖尿病,在转移脾细胞后55 d所有受体鼠均发生糖尿病,但这种静息的AI4 CD8+T细胞却不能将糖尿病转移到NOD.scid受体鼠(图 4)。静息AI4 CD8+T细胞转移到NOD.scid鼠60 d后尚未发现有受体鼠发生胰岛炎,但在120 d时NOD.scid组的部分受试对象发生外周胰岛炎和胰岛炎(图 5)。
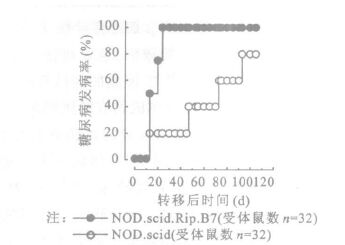
|
图 2 转移7×105 CD8+T细胞 |
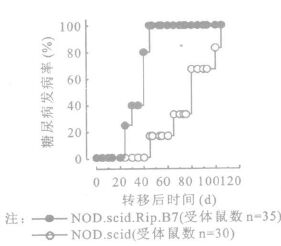
|
图 3 转移7×104 CD8+T细胞 |
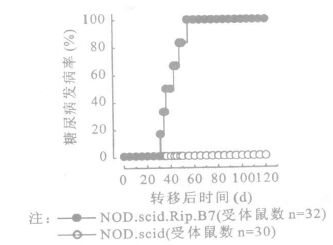
|
图 4 静息的CD8+T细胞不能将糖尿病过继转移给NOD.scid鼠 |

|
图 5 120 d时NOD.scid组外周胰岛炎和胰岛炎 (HE,×200) |
3 讨论
本研究以NOD鼠作动物模型,利用基因工程构建NOD背景的转基因鼠来研究CD8+T细胞在1型糖尿病发病中的作用。首先检验了幼年NOD鼠体内是否存在胰岛β细胞特异性的致糖尿病性T细胞。将14 d龄NOD鼠的脾细胞转移给6~8周龄NOD.scid.Rip.B7鼠和年龄与之匹配的NOD.scid鼠[7]。转移脾细胞后11周100%的NOD.scid.Rip.B7鼠发生糖尿病,而在NOD.scid对照组,即使转移脾细胞后20周仍然没有受体鼠发生糖尿病。另外,在转移脾细胞后9周,当大部分NOD.scid.Rip.B7受体鼠发生糖尿病时,在NOD.scid受体鼠组尚没有检测到胰岛淋巴细胞浸润。2周龄NOD小鼠的脾细胞可将糖尿病转移到NOD.scid.Rip.B7小鼠中,说明14 d龄的NOD鼠的脾细胞含有β细胞特异性T细胞。在NOD.scid受体鼠中无胰岛炎和糖尿病,也表明在幼年NOD鼠中的T细胞库和/或致糖尿病的T细胞的数量有限。转移3周龄NOD鼠的脾细胞后,2组受体鼠均有糖尿病发生,但对照组NOD.scid组的发病率(转移后9周时发病率13%)远低于NOD.scid.Rip.B7试验组的发病率(转移后9周时发病率100%)(P < 0.001), 表明T细胞的致糖尿病能力随着NOD供体鼠年龄的增长而增加 (如图 3)。实验组与对照组糖尿病发生率的明显差异表明,CD80在β细胞上的表达促进了静息T细胞对糖尿病的转移诱导,提供了T细胞与胰岛β细胞直接作用的证据。但静息CD8+T细胞不能将糖尿病转移到NOD.scid受鼠。静息AI4 CD8+T细胞注射到NOD.scid鼠60 d后尚未发现有受体鼠发生胰岛炎,但在120 d时NOD.scid组的部分受试对象发生外周胰岛炎和胰岛炎。在β细胞上表达共刺激分子CD80的NOD.scid.Rip.B7受体鼠糖尿病的快速发生证明了CD8+T细胞和β细胞之间的直接作用,NOD.scid受体鼠胰岛炎的低发生率提示CD80在胰岛淋巴细胞浸润过程中对静息CD8+T细胞发挥了协同刺激作用。
由于人类和NOD鼠在组织相容性复合物(MHC)Ⅱ类等位基因和1型糖尿病易感性之间的强大的基因连锁性,过去的多数研究集中于CD4+T细胞在糖尿病发病中的作用,并且认为CD4+T细胞启动胰岛炎,而CD8+T细胞只起辅助作用,负责β细胞的最后破坏[13, 14]。本研究发现,当2周龄NOD鼠的脾细胞转移到有T细胞缺陷的NOD鼠(即NOD.scid鼠)时,不引起受鼠胰岛炎和糖尿病,而当2周龄NOD鼠的脾细胞转移到有共刺激分子CD80的T细胞缺陷的NOD鼠(即NOD.scid.Rip.B7鼠)时,不但引起受鼠胰岛炎而且促进其糖尿病的加速发展,表明CD8+T亚群启动了胰岛的淋巴细胞浸润,而且CD8+T细胞是通过与胰岛β细胞直接作用启动糖尿病的发生。
| [1] | Delovitch, T L, B Singh. The nonobese diabetic mouse as a model of autoimmune diabetes:immune dysregulation gets the NOD[J]. Immunity, 1997, 7 : 727–738. DOI:10.1016/S1074-7613(00)80392-1 |
| [2] | Wucherpfennig, K W, and Eisenbarth G S. Type 1 diabetes[J]. Nat Immunol, 2001, 2 : 767–768. DOI:10.1038/ni0901-767 |
| [3] | Dilts S M, Solvason N, and Lafferty K J. The role of CD4 and CD8 T cells in the development of autoimmune diabetes[J]. J Autoimmun, 1999, 13 : 285–290. DOI:10.1006/jaut.1999.0323 |
| [4] | Kay T W, Chaplin H L, Parker J L, et al. CD4+ and CD8+ T lymphocytes:clarification of their pathogenic roles in diabetes in the NOD mouse[J]. Res Immunol, 148 : 320–327. DOI:10.1016/S0923-2494(97)87241-0 |
| [5] | Wong F S, Janeway C A. The role of CD4 vs.CD8 T cells in IDDM[J]. J Autoimmun, 1999, 13 : 290–295. DOI:10.1006/jaut.1999.0322 |
| [6] | Antonio Gonalez, Jonathan D Katz, Marie-Genevieve Mattei, et al. Genetic control of diabetes progression[J]. Immunity, 1997, 7 : 873–883. DOI:10.1016/S1074-7613(00)80405-7 |
| [7] | Judith A Cain, Judith A Smith, Jennifer K Ondr, et al. NKT Cells and IFN-establish the regulatory environment for the control of diabetogenic T cells in the nonobese diabetic mouse[J]. The Journal of Immunology, 2006, 176 : 1645–1654. DOI:10.4049/jimmunol.176.3.1645 |
| [8] | Teresa P Dilorenzo, Robert T Graser, Toshiro Ono, et al. Major histocompatibility complex classs Ⅰ-restricted T cells are required for all but the end stages of diabetes development in nonobese diabetic mice and use a prevalent T cell receptor α chain gene rearrangement[J]. Proc Natl Acad Sci USA, 1998, 95 : 12538–12543. DOI:10.1073/pnas.95.21.12538 |
| [9] | F Susan Wong, Irene Visintin, Li Wen, et al. The role of lymphocyte subsets in accelerated diabetes in nonboese diabetic-rat insulin promoter-B7-1(NOD-RIP-B7-1) mice[J]. J Exp Med, 1998, 187 : 1985–1993. DOI:10.1084/jem.187.12.1985 |
| [10] | Graser R T, T P DiLorenzo, F Wang, et al. Identification of a CD8 T cell that can independently mediate autoimmune diabetes development in the complete absence of CD4 T cell helper functions[J]. J Immunol, 2000, 164 : 3913–3918. DOI:10.4049/jimmunol.164.7.3913 |
| [11] | Sherri W Christianson, Leonard D Shultz, Edward H Leiter. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice:relative contributions of CD4+and CD8+ T-cells from diabetic versus prediabetic NOD.NON-Thy-1a donors[J]. Diabetes, 1993, 42 : 44–55. DOI:10.2337/diab.42.1.44 |
| [12] | Wang B, A Gonzalez, C Benoist, et al. The role of CD8+T cells in the initiation of insulin-dependent diabetes mellitus[J]. Eur J Immunol, 1996, 26 : 1762–1769. DOI:10.1002/(ISSN)1521-4141 |
| [13] | Schmidt D, J Verdaguer, N Averill, et al. A mechanism for the major histocompatibility complex-linked resistance to autoimmunity[J]. J Exp Med, 1997, 186 : 1059–1075. DOI:10.1084/jem.186.7.1059 |
| [14] | Kurrer M O, S V Pakala, H L Hanson, et al. Beta cell apoptosis in T cell-mediated autoimmune diabetes[J]. Proc Natl Acad Sci USA, 1997, 94 : 213–218. DOI:10.1073/pnas.94.1.213 |
 2007, Vol. 23
2007, Vol. 23
