2. 黑龙江省药品检验所
呼吸道合胞病毒(RSV)是一个世界范围内婴幼儿最常见的呼吸道感染的病原体。目前,对RSV的防治仍无有效的疫苗和药物〔1〕。近年来,国内外有关抗病毒中药的研究日益增多,从中筛选其有效成分已成为当前抗病毒新药开发的一个热点〔2〕。本课题组在2004年报道甘草水提液具有明显的抗RSV的作用;在2005年发现甘草有效部位GC3-1-4具有抗RSV的作用基础上〔3〕, 进一步分离到抗病毒活性成分(GX),并在细胞水平上检测其抗RSV的作用。现将结果报告如下。
1 对象与方法 1.1 材料甘草(产地内蒙古,经黑龙江省药品检验中药研究所鉴定)。利巴韦林注射液(天津药业集团新郑股份有限公司, 批号:0610152)。人宫颈癌传代细胞(Hela), (中国疾病预防控制中心病毒研究所)。呼吸道合胞病毒(RSV-Long株)(中国疾病预防控制中心病毒研究所)。RSV在Hela细胞中的组织半数感染量(TCID50)为1×10-6.6/0.2 ml。本次实验采用100TCID50/0.2 ml的感染量。硅胶制备板(安徽良臣硅源材料厂)。甲醇、三氯甲烷、无水乙醇等,均为分析纯(天津市博迪化工有限公司)。中性红(上海华舜生物工程有限公司),用磷酸盐缓冲液稀释。脱色液:由无水乙醇、枸橼酸钠和盐酸组成。
1.2 方法 1.2.1 甘草抗病毒活性成分(GX)的制备甘草经水煎煮浸提、醇沉、大孔吸附树脂柱层析得到的GC3-1-4, 再经由氯仿和甲醇组成的展开剂,在硅胶板上经薄层层析得GX。
1.2.2 药物毒性实验用细胞维持液将GX和利巴韦林释为7个浓度组,分别加入到Hela细胞已长成单层的96孔培养板上。同时设正常细胞对照组。置35℃、5% CO2培养箱培养3 d后,弃去维持液, 每孔添加0.2 ml中性红染液, 放回培养箱培养2 h。取出后用磷酸盐缓冲液(PBS)洗2次, 添加0.2 ml脱色液。室温暗处放置30 min后, 酶标仪450 nm波长下测吸光度(A)值〔4〕,测定细胞存活率,求药物半数中毒浓度(TC50)。细胞存活率=药物组平均A值/细胞对照组平均A值×100%。
1.2.3 药物抗RSV实验参照文献〔5〕。实验分3组进行。(1) 药物的抑制作用:在96孔板上,接种100TCID50/0.2 ml RSV液,0.2 ml/孔。吸附2 h后,分别加入不同浓度的GX和利巴韦林。置培养箱中培养。同时设正常细胞对照组和病毒对照组,待病毒对照组细胞病变(CPE)为4时,中性红实验同上, 测定病毒抑制率,求药物的半数有效浓度(EC50)和治疗指数(TI)。病毒抑制率=〔实验组(药物+病毒)平均A值-病毒对照组平均A值〕/〔正常细胞对照组平均A值-病毒对照组平均A值〕×100%。CPE记录规则:0为细胞无CPE;1为0~25% CPE;2为25%~50% CPE;3为50%~75% CPE;4为75%~100% CPE。TI=TC50/EC50。(2) 不同时间给药对RSV抑制作用:向96孔板中,加入100TCID50/0.2 ml RSV液,0.2 ml/孔,分别作用2,4,6,8,10,12 h后吸弃病毒液,再分别加入GX(浓度为120.00 μg/ml)和利巴韦林(浓度为80.00 μg/ml),培养方法同上。待病毒对照组CPE为4时,记录CPE结果。(3) 药物的中和作用:200TCID50/0.2 ml RSV液与含不同浓度药物的维持液等体积混合,35℃作用2 h后, 加到96孔板中,0.2 ml/孔。吸附2 h,弃上清,加细胞维持液,置培养箱中培养。待病毒对照组CPE为4时,记录CPE结果。
1.3 统计分析采用SAS 8.2软件进行分析。利用Reed-Muench法测定病毒TCID50,Logit回归计算药物TC50和EC50〔6〕。不同时间处理组或不同剂量组与病毒对照组之间的结果比较采用Kruskal-Wallis法。
2 结果 2.1 药物毒性结果测定根据中性红实验测定细胞存活率,Logit回归计算得GX的TC50为460.00 μg/ml,利巴韦林的TC50为1.01 mg/ml。
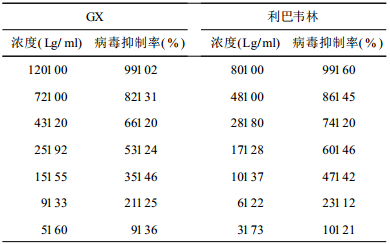
2.2 药物对细胞内RSV抑制作用(表 1)| 表 1 GX和利巴韦林对RSV的抑制作用 |
经Logit回归方法计算得GX的EC50为23.53 μg/ml,利巴韦林的EC50为12.90 μg/ml。所以GX的TI为19.55,利巴韦林的TI为78.29;GX在一定浓度时对RSV在Hela细胞内的复制有明显的抑制作用。
2.3 不同时间给药对RSV抑制作用Kruskal-Wallis检验结果表明,在RSV感染2,4,6,8,10 h后给药,GX和利巴韦林组细胞病变(CPE)程度均低于病毒对照组,且差异有统计学意义(P < 0.01),说明在RSV感染2,4,6,8,10 h后给药,GX仍具有抑制RSV在Hela细胞内复制的作用。
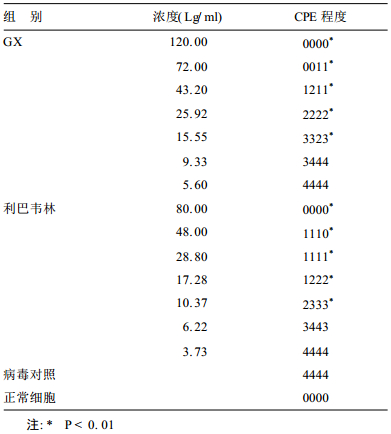
2.4 药物对RSV的中和作用(表 2)| 表 2 GX和利巴韦林对RSV中和作用 |
GX15.55 μg/ml及以上各药物浓度组CPE程度均低于病毒对照组CPE, 差异有统计学意义(P < 0.01);利巴韦林10.37 μg/ml及以上各药物浓度组CPE程度也低于病毒对照组CPE,差异也有统计学意义(P < 0.01)。说明GX在一定浓度时,对病毒有较好的直接灭活作用。
3 讨论本实验用抗病毒活性作为导向分离方法从甘草中分离到抗病毒成分GX。为了验证GX抗RSV的作用,实验中RSV病毒感染量定为100TCID50/0.2 ml,并设立了严格对照组(正常细胞对照,病毒对照和阳性药物对照)。结果表明GX对RSV复制有明显的抑制效果,其EC50为23.53 μg/ml,TI为19.55。结果也表明,GX抗RSV作用是多途径的,不仅有直接灭活病毒的作用,而且对于进入细胞的病毒,无论是在病毒复制的早期,还是在病毒复制的中晚期,均有一定的抑制作用。
目前,大多数研究认为甘草中有抗病毒作用的主要成分是甘草酸〔7〕和甘草多糖〔8〕。实验中,初步验证GX不是甘草酸和甘草多糖,可能是一种新的抗病毒物质,因此,应对GX化学结构进行深入研究。体外研究不能充分体现药物在体内的生化转化效应, 本实验有待于在动物体内检验其抗RSV的作用;GX是通过抑制病毒核酸复制, 还是通过阻止病毒蛋白合成,而实现对RSV复制的抑制,其具体作用机制尚需研究。
| [1] | Lucia FB. Prevention of respiratory syncytial virus infection[J]. Rev Hosp Clin Fac Med Sao Paulo, 2001, 56(3) : 79–90. |
| [2] | 朱丹, 刘华刚. 抗病毒中药的最新研究进展[J]. 中国医学文摘:内科学, 2005, 26(6) : 747–748. |
| [3] | 刘鑫妍, 李洪源, 王秀琴, 等. 甘草抗病毒有效部位(GC3-1-4)体外抑制呼吸道合胞病毒的研究[J]. 中医药信息, 2006, 23(4) : 65–67. |
| [4] | Mark RP, Dale LB, Paul FT. Potent inhibition of respiratory syncytial virus replication using a 2-5A-antisense chimera targeted to signals within the virus genomic RNA[J]. Proc Natl Acad Sci U S A, 1998, 95(15) : 8874–8879. DOI:10.1073/pnas.95.15.8874 |
| [5] | 何静, 杨占秋, 石丽桥, 等. 盐酸阿比朵尔抗呼吸道合胞病毒机制初探[J]. 武汉大学学报:医学版, 2006, 27(1) : 69–71. |
| [6] | 刘昌孝, 孙瑞元. 药物评价实验设计与统计学基础[M]. 北京: 军事医学科学出版社, 1999: 31-32. |
| [7] | Jeffrey IC. Licking latency with licorice[J]. J Clin Invest, 2005, 115(3) : 591–593. DOI:10.1172/JCI24507 |
| [8] | 汲晨锋, 姜薇, 王晓晶. 甘草多糖的化学与药理研究[J]. 哈尔滨商业大学学报:自然科学版, 2004, 20(5) : 515–518. |
 2007, Vol. 23
2007, Vol. 23

 , 王吉锡1, 李鑫1, 朴英爱2, 陈振华1, 谢志平1, 杨庆伟1
, 王吉锡1, 李鑫1, 朴英爱2, 陈振华1, 谢志平1, 杨庆伟1