碘是机体必需的微量元素, 是甲状腺合成甲状腺激素的基本原料。机体在碘摄入不足或过量时都会影响甲状腺激素的合成水平, 从而影响机体正常的生长发育或导致一系列甲状腺疾病。而全民食盐加碘的普及在预防碘缺乏病的同时也将我国部分高碘地区居民是否碘摄入过量, 以及目前碘盐中碘酸钾(KIO3)为主, 而KIO3属强氧化剂, 对其生物利用度及安全性也提出了质疑〔1〕。本研究选取适于研究人类碘与甲状腺疾病的远交封闭系Wistar大鼠作为研究对象, 通过复制动物模型来探讨不同碘摄入水平对机体碘代谢及甲状腺功能的影响, 同时观察KIO3的生物安全性。
1 材料与方法 1.1 实验动物与分组选用断乳后1个月, 体质量在120~140 g的Wistar大鼠180只(北京实验动物研究中心, 属SPF/ VAF级动物); 雌雄各半, 按体重、性别随机均分为6组:低碘组(LI); 适碘组(NI); 5倍碘过量组(5HI); 10倍碘过量组(10HI); 50倍碘过量组(50HI); 100倍碘过量组(100HI)。每组分3、6、12个月三个饲养时段, 各10只包括雌雄各5只。LI组动物饲以低碘地区的粮食制成的饲料(平均碘含量为50 μg/kg左右), 并添加动物必需微量元素和维生素。其它5组饲以正常大鼠饲料(平均碘含量为300μg/kg左右)。LI组饮用去离子水(碘含量为0μg/L); NI组饮用自来水(水碘5μg/ L); 5HI、10HI、50HI、100HI组分别饮用含不同浓度的KIO3的自来水, 含碘量(以I计)分别为820, 1845, 10045和20 295 μg/L。按大鼠每日进食20 g, 进水30 ml估计每只大鼠每日的总摄碘量为: LI组 < 1.00μg; NI组6.15μg; 5HI组30.75 μg; 10HI组61.50μg; 50HI组307.50μg; 100HI组, 615.00 μg。
1.2 实验方法各组大鼠分别在饲养3, 6和12月时用代谢笼收集其尿液, 处死大鼠后取血分离血清并摘取甲状腺。
1.2.1 尿碘测定收集各组大鼠尿样, 采用过硫酸铵消化-砷铈催化分光光度法测定〔2〕
1.2.2 甲状腺组织碘含量测定千分之-天平准确称量每只大鼠的甲状腺质量, 并取少量制备5 mg/ml的组织匀浆液, 采用氯酸消化一砷铈催化分光光度法测定〔3〕。
1.2.3 血清激素测定TT4、TT3、FT4、FT3的测定采用化学发光免疫分析方法, 设备及试剂均为德国拜耳公司产品。
1.2.4 甲状腺组织激素的提取和测定参照文献〔4〕方法略加修改。采用放射免疫分析(RIA)方法。
1.3 统计分析采用SPSS统计软件进行分析, 尿碘以中位数表示, 采用秩和检验; 甲状腺组织含碘量和血清、甲状腺组织激素水平均以 x±s表示, 组间均值比较采用方差分析, 多重比较采用最小显著差法(LSD)。
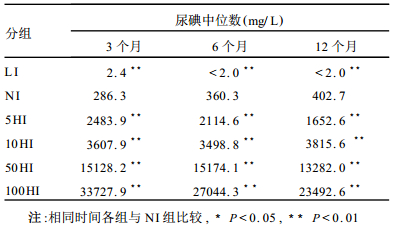
2 结果 2.1 尿碘水平(表 1)干预时间3, 6和12个月时检测结果显示, L I组大鼠的尿碘水平均呈现极低状态, 而与NI组比较, 5, 10, 50, 100HI组随着摄碘量的提高, 尿碘水平成倍增加。
| 表 1 各组大鼠尿碘水平测定(n=10) |
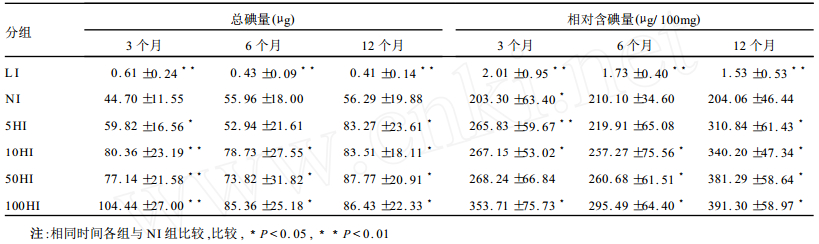
2.2 甲状腺组织含碘量(表 2)
| 表 2 各组大鼠甲状腺组织含碘量测定(n=10) |
L I组在1年的干预时间内甲状腺含碘量由于摄入量的不足始终呈现极低水平, 而5, 10, 50, 100HI与NI组比较, 在甲状腺总碘量和相对含碘量2个方面虽均有提高, 但幅度并不与碘摄入量的倍数(5, 10, 50, 100倍)相一致, 最高不过NI组的2倍左右。
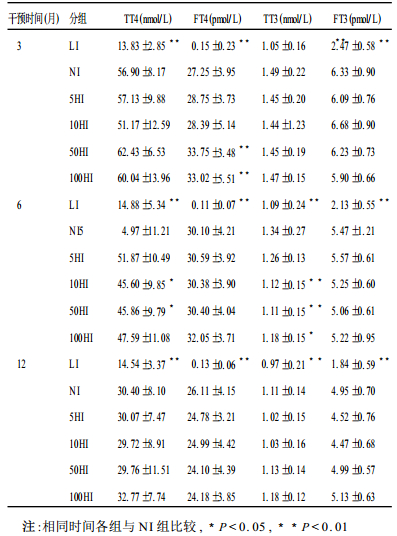
2.3 血清甲状腺激素水平(表 3)| 表 3 大鼠血清甲状腺素水平的变化(n=10) |
L I组TT4、FT4、、TT3、FT3浓度均显著低于NI组(P < 0.01)。而各HI组与NI组, 激素水平差异较小, 但可见6个月TT4、TT3自10HI组有所下降, 而FT4仅在3个月50HI、100HI组略见升高, 在6, 12个月时均处于与NI组相同的水平。
2.4 甲状腺组织激素水平L I组大鼠甲状腺组织T4、T3在实验期间(1年)均显著低于NI组(P < 0.01)。而HI组中仅100HI组T4含量在6和12个月低于NI组, 差异有统计学意义; 而T3含量则随着碘摄入的增加有下降趋势。
3 讨论L I组大鼠由于每日碘摄入量不足1μg, 远低于大鼠的生理需要量(6~9μg), 其尿碘和甲状腺含碘量均远远低于NI组。碘原料的不足也进一步引起了甲状腺激素的合成障碍, 导致甲状腺组织和血清中的甲状腺激素严重不足, 进而造成全身的甲状腺功能低下。另一方面, 在干预时间内碘过量组(5, 10, 50, 100HI)的尿碘排泄量却明显增加, 且增加幅度与碘摄入量的倍数(5, 10, 50, 100倍)基本平行。然而, 各HI组大鼠无论甲状腺组织总碘量还是相对含碘量却最高, 不过为NI组的2倍左右, 仅表现为轻度增加而并非随摄碘量的成倍增加而成比例的增高。这也提示当碘摄入过量时机体对碘的自主调节和钠-碘转运体(NIS)调控的存在, 甲状腺上皮可通过减少对碘的摄取来调控激素的合成与释放〔5〕。但长期过量摄取碘也会破坏稳态, 甲状腺组织内T3、T4出现不同程度降低。T3下降考虑可能与甲状腺在碘过量时MIT (一碘甲腺原氨酸)合成较少, 以及甲状腺作为浓集碘的主要器官, 过量碘抑制了甲状腺组织内的5′-脱碘酶活性有关〔6〕。而T4的相对稳定则表明机体对碘过量的一种代偿, 避免因碘过多合成过多激素而导致甲亢倾向。但较长时间(6和12个月)的持续性大量碘摄入(100HI组)则会抑制甲状腺内的T4和T3的合成。另外, 血清甲状腺激素的变化也与碘过量的剂量以及持续时间有关。在碘过量的早期(3个月时)仅50和100HI组出现FT4轻度升高, 即甲亢的危险性增高。当碘过量持续达6个月时, 自10 HI组即出现了甲减的趋势, 表现为TT4、TT3的明显下降, 然而FT4、FT3仍保持在正常水平, 又显示其良好的代偿能力。但碘过量持续达12个月时, TT4、TT3、FT4和FT3又处于完全正常水平, 与NI组差异无统计学意义, 提示大鼠对碘过量的强大代偿能力。
本实验结果表明, 长期碘摄入不足会导致机体呈现严重的碘缺乏状态, 并造成甲状腺功能低下。而与大鼠对碘缺乏耐受性低相对应的是, 它对过量碘的摄入, 呈现出较强的自我保护和代偿能力。即使大鼠碘摄入量达生理需要量几十倍以上, 甲状腺也不再过多的摄取碘, 而是将摄入过多的碘从尿液中排泄并不在体内潴留, 从而使甲状腺含碘量维持在一个相对稳定的水平〔7〕。然而, 长时间严重碘过量也会造成甲状腺功能的改变并处于失代偿状态。结果提示, 在关注碘缺乏所带来危害的同时, 也应对长期摄入过量碘予以足够的重视。同时, 研究结果我国目前实施的以KIO3为碘剂的食盐加碘是安全的。
| [1] | 赵文德, 张春熙. 市售碘盐中碘酸钾在体内利用率的研究[J]. 中国地方病学杂志, 2000, 19(3-1) : 36–38. |
| [2] | 阎玉芹, 张亚平, 刘列钧, 等. 尿中碘的过硫酸胺消化-砷铈催化分光光度测定方法[J]. 中国地方学病杂志, 2004, 23(6) : 582–585. |
| [3] | 阎玉芹, 刘列钧, 张亚平, 等. 尿碘的砷铈催化分光光度测定方法[J]. 中国地方学病杂志, 1997, 16(1) : 37–40. |
| [4] | Chopra IJ, Fisher DA, Solomon DH, et al. Thyroxine and triiodothyronine in the human thyroid[J]. J Clin Endocrinol Metab, 1973, 36(2) : 311–316. DOI:10.1210/jcem-36-2-311 |
| [5] | Dohan O, De la Vieja A, Paroder V, et al. The sodium/iodide symporter (NIS): characterization, regulation, and medical significance[J]. Endocr Rev, 2003, 24(1) : 48–77. DOI:10.1210/er.2001-0029 |
| [6] | Wang K, Sun YN, Liu J Y, et al. Type 1 iodothyronine deiodinase activity and mRNA expression in rat thyroid tissue with different[J]. Chin Med J, 2006, 119(22) : 1899–1903. |
| [7] | Chen Zupei, Lin Laixiang, Nie Xiuling, et al. Iodine metabolism and thyroid function in rat model induced by iodine deficiency and iodine excess at different levels of high iodine intake[J]. Thyroid, 2005, 15(Supple 1) : 170–171. |
 2007, Vol. 23
2007, Vol. 23