目前职业病临床治疗汞中毒主要应用螯合剂疗法, 以驱汞为主, 辅以对症治疗。但对汞中毒疼痛缺乏有效治疗措施。许多患者即使驱汞多个疗程, 而疼痛依然顽固如初。为了探索汞中毒疼痛的发病机制, 寻找有效镇痛方法, 进行本项研究。结果报告如下。
1 材料与方法 1.1 实验动物健康SD大鼠30只, 雌雄各半, 体重160~200 g (上海希蒲尔必凯实验动物有限公司)。按雌雄分开, 每笼5只。本院动物房饲养, 自由摄食饮水。为排除针刺、抓挠、经口灌胃等多种因素对大鼠脊髓GFAP表达的影响, 设立对照组。分组染汞, 将动物随机分为3组, 每组10只, 雌雄各5只。大剂量组按17 mg/ kg (1/ 4 LD50)、小剂量组按815 mg/ kg (1/ 8 LD50)经口灌胃HgCl2溶液, 1次/ d; 对照组经口灌胃生理盐水2 ml, 1次/ d。3组均连续灌胃(20±2) d, 将染汞组制成亚急性汞中毒模型。
1.2 汞中毒判断标准动物出现步态不稳, 行动障碍或痉挛〔1〕。疼痛判断标准:动物出现抓舔肢体、甩尾、嘶叫、翻身、转圈等表现〔2〕。超过50%的动物出现中毒症状后停止染汞, 判定为造模成功。
1.3 药物干预造模成功后各组均处死5只雄鼠, 留5只雌鼠作药物干预试验。小剂量染汞组用二巯丙磺钠注射液(DMPS), 按28 mg / kg腹腔注射驱汞2个疗程(驱3 d, 休4d为1个疗程), 驱汞期间经口灌胃生理盐水1 ml/ d, 送胃14 d。大剂量染汞组用同样方法驱汞, 在驱汞期间用己酮可可碱(POF)溶液按29.22 mg / (kg·d)经口灌胃, 14 d。对照组腹腔注射生理盐水1 ml/ d, 注射3 d, 休息4 d为1个周期, 共注射2个周期, 在此期间经口灌胃生理盐水1 ml/次, 共14 d。实验结束后处死全部动物。
1.4 动物处死与取材方法用1%戊巴比妥钠, 按40 mg/ kg腹腔注射麻醉动物, 随后将其固定于解剖台上, 剖胸做心脏穿刺, 将针头固定于升主动脉, 先灌注生理盐水约150 ml, 再灌注4%多聚甲醛磷酸缓冲液(pH7.4)约200 ml。待动物僵硬后取出脊髓L5-6节, 置于10%的甲醛磷酸缓冲液中固定, 按常规制成病理切片。
1.5 检测项目、试剂与仪器实验用HgCl2(上海化学试剂总厂)分析纯度为99.99%, 生产批号为990402; DMPS (上海禾丰制药有限公司)生产批号为0309011; POF (德国Merckle GmbH药业公司)生产批号为C20571;胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)试剂盒(武汉博生微生物工程有限公司)编号为SA1025;微量白蛋白(mALB)检测试剂盒(伊利康生物技术有限公司)生产批号为040902。用Z-5000原子吸收光谱仪(日本日立电子有限公司)按冷原子吸收法测定尿汞; 用CHEMI STRY ANALYZER RT~1904C半自动生化分析仪按免疫透射比浊法〔3〕测定尿微量白蛋白; 用免疫组化链酶亲和素-生物素-过氧化物酶聚合物(streptavidin -biotin -peroxidase complex, SABC)法〔3〕测定脊髓GFAP。按照试剂盒说明书操作, 用400倍光学显微镜观察并摄片, 用LEICA QWIN V3图像分析软件对病理切片进行分析。灰度测量:将切片中图像通过摄像头转入计算机图像分析系统, 根据其颜色的深浅、阳性部分反应强弱, 判定灰度的大小。灰度分256级, 从0~255级, 0级最深, 表示阳性反应强; 255最浅, 表示阳性反应弱。脊髓背角可以分成表层(Ⅰ层和Ⅱ层), 中间层(Ⅲ和Ⅳ层), 深层(V层和VI层), 记数GFAP在整个背根的表达数。
1.6 统计分析将数据输入Excel表格, 用SPSS 10.0软件进行分析, 采用Homo geneity-of -variance进行方差齐性检验, 若方差齐, 则进行单因素方差分析(One-way ANOVA), 并采用Dunnett-test进行实验组与对照组均数间两两比较; 若方差不齐, 则用Kruskal -Wallis test作非参数统计, 用Mann-Whitney test进行均数间两两比较。α=0105。
2 结果 2.1 动物染毒与中毒表现大剂量组大鼠于染汞第12 d时开始出现口腔流涎, 口腔出现血性分泌物, 精神萎靡, 活动减少, 步态僵硬、笨拙, 皮毛粗糙, 尿量增多, 大便稀。于染汞第19 d有7只大鼠出现汞中毒表现, 停止染汞。汞中毒大鼠中有1只雄鼠和1只雌鼠出现疼痛表现; 该大鼠不停的舔、抓后脚、下肢和尾部, 致使该部位出现红肿, 甚至部分皮肤破损, 该大鼠并未受伤, 故判断为汞中毒疼痛。小剂量组大鼠于第16d开始出现口腔流涎, 口腔有血性分泌物, 活动减少, 步态笨拙, 精神倦怠, 皮毛粗糙, 尿量增多, 大便稀。于第22 d有6只大鼠出现汞中毒表现, 停止染汞, 无疼痛大鼠出现。对照组大鼠全部正常生存。
2.2 尿汞与尿微量白蛋白测定(表 1)| 表 1 3组尿汞与尿微量白蛋白检测结果( x ± s) |
分别于造模成功后(驱汞前)及驱汞2个疗程后(驱汞后)留取各组大鼠的24 h尿, 测定尿汞与尿微量白蛋白。驱汞前、后2染汞组大鼠尿汞均显著高于对照组(P < 0.01), 大剂量组尿汞显著高于小剂量组(P < 0.05)。大、小剂量染汞组大鼠尿微量白蛋白均显著高于对照组(P < 0.05), 但大、小剂量组之间尿微量白蛋白差异无统计学意义(P > 0.05)。
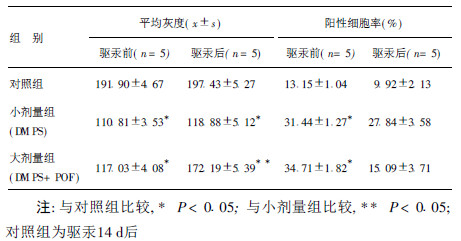
2.3 GFAP测定结果(表 2)| 表 2 3组GFAP平均灰度与阳性细胞率 |
驱汞前, 2染汞组大鼠脊髓GFAP平均灰度值均显著低于对照组, 阳性细胞率均显著高于对照组(P < 0.05)。2染汞组GFAP平均灰度值及阳性细胞率之间差异无统计学意义(P > 0.05)。驱汞后, 大剂量组平均灰度值显著升高, 阳性细胞率显著下降, 与对照组比较, 差异无统计学意义(P > 0.05), 小剂量组平均灰度值及阳性细胞率均无明显变化。大剂量组平均灰度值显著高于小剂量组(P < 0.05), 说明己酮可可碱可有效抑制星形胶质细胞激活。
3 讨论汞在常温下即可挥发, 对照组大鼠与染汞组大鼠长期饲养在同一室内, 必然吸入含汞气体。结果表明, 对照组大鼠尿内也含汞和微量白蛋白, 而且它们随着染汞组不断驱汞而逐渐减少。
尿汞及尿微量白蛋白测定结果表明, 汞对大鼠肾脏损伤较重。近期疼痛机制研究表明, 胶质细胞激活是神经病理性疼痛发生、发展和持续存在的关键因素。在中枢或周围神经损伤、机体受到细菌、病毒感染, 骨癌等病理状态下, 星形胶质细胞被激活, 细胞数量增多, 体积增大, 突起增多。GFAP表达上调〔4, 5〕。激活的胶质细胞可以分泌多种神经化学物质, (ATP)等〔6〕。这些从胶质细胞释放的神经活性物质和促炎细胞因子作用于脊髓背角的痛觉神经元, 使其胞体和突触的反应性、可塑性发生改变, 动作电位阈值降低, 损伤处及其临近的背根神经节细胞发出的一些异位阈下神经冲动变为阈上有效刺激, 频繁向大脑发出痛信号, 形成自发性疼痛。另一方面, 这些细胞因子还可以进一步增强初级传入神经末稍伤害性神经递质的释放, 形成正反馈效应, 增强突触后痛觉传递神经元的敏感性和反应性, 使疼痛程度和痛源区域夸大化, 最终形成痛觉过敏和疼痛的持续状态〔6, 7〕。此外, 星形胶质细胞之间以及胶质细胞与神经元之间通过缝隙连接的电耦合形式传递信息, 与神经元间发生钙离子依赖的信息转导作用。实验表明, 抑制胶质细胞激活可以阻断这一系列复杂的反应过程, 有效缓解病理性疼痛〔8〕。因此, 胶质细胞已成为目前治疗慢性疼痛的新靶点。POF可以有效抑制胶质细胞激活, 可使GFAP平均灰度值显著升高、阳性细胞率显著降低, 因此, POF有可能在汞中毒疼痛治疗中起到积极作用。
(山东省立医院宋文阁教授, 赵学军副主任医师, 山东省职防院郭启明, 张树来, 张振玲等同志对本研究提出了许多宝贵建议, 特此致以衷心感谢!)| [1] | 曹秉振, 常高峰, 曹霞, 等. 氯化甲基汞中毒大鼠周围神经损伤的病理演变[J]. 第二军医大学学报, 2004, 25(11) : 1190–1194. |
| [2] | 江澄川, 赵志奇, 蒋豪, 等. 疼痛的基础与临床[M]. 上海: 复旦大学出版社, 2001: 1-7. |
| [3] | 王兰兰, 柳永和, 李双庆, 等. 临床免疫学和免疫检验[M].5版. 北京: 人民卫生出版社, 2003: 53-243. |
| [4] | Watkins LR, Maier SF. The pain of being sick: implications of immue to brain communication for understanding pain[J]. Annu Rev Psychol, 2000, 51 : 29–57. DOI:10.1146/annurev.psych.51.1.29 |
| [5] | Hashizume H, Rutkowski MD, Weinstein JN, et al. Central administration of methotrexate reduces mechanical allodynia in an animal model of radiculopathy/ sciatica[J]. Pain, 2000, 87(2) : 159–169. DOI:10.1016/S0304-3959(00)00281-5 |
| [6] | Hashizume H, Deleo JA, Colurn RW, et al. Spinal glial activation and cytokine expression after lumerroot injury in the rat[J]. Spine, 2000, 25 : 1206–1217. DOI:10.1097/00007632-200005150-00003 |
| [7] | Lau LT, Yu ACH. Astrocyte produce and release interleukin-1, interleukin-6, tumor necrosis fact or alpha and interferon-gamma following traumatic and metabolic injury[J]. J Neurotrauma, 2001, 18 : 351–359. DOI:10.1089/08977150151071035 |
| [8] | Sweitzer SM, Schubert P, Deleo JA. Propent of ylline: a glial modulating agent exhibits anti-allodynic prooerties in a rat model of neuropathic pain[J]. J Pharmacol Exper Ther, 2001, 297 : 1210–1217. |
 2007, Vol. 23
2007, Vol. 23