2. 河北工程大学医学院;
3. 郑州大学河南省分子医学重点实验室
幽门螺杆菌(Helicobacter pylori, Hp)是一种可长期定植于人类胃粘膜的革兰阴性微需氧菌, 在全世界范围内感染率超过50%。Hp是引起萎缩性胃炎和胃溃疡等慢性炎症的致病因子, 流行病学和动物实验证实, Hp慢性感染是导致胃癌的重要危险因素, 世界卫生组织已将其列为一类致癌原〔1〕。然而Hp确切的致癌机制至今仍不清楚。细胞毒素相关基因A蛋白(cytotox in associated g ene A, CagA)是Hp重要的毒力因子之一。流行病学研究认为, CagA阳性Hp感染与消化性溃疡和胃癌发生的关系比CagA阴性菌株更为密切, 提示cagA在Hp致病过程中可能具有重要作用〔2, 3〕。世界范围内不同Hp菌株CagA分子变异较大, 该变异可能导致不同菌株的CagA生物学作用乃至致病性不同〔4〕。我国作为Hp感染较严重的国家之一, 临床分离株中超过90%含有cagA基因, 但对于毒力因子CagA的生物学功能不甚明了。另外, 由于cagA阳性野生株与cagA阴性自然突变株之间缺乏除cagA基因以外的相同遗传背景, 所以无法对cagA基因功能做出真实判断。为此, 本室在自行构建的幽门螺杆菌中国株cagA基因缺失突变株的基础上, 探讨野生株与突变株对人胃癌细胞株BGC823细胞增殖和凋亡的影响, 旨在揭示与Hp毒力基因cagA相关的细胞水平的毒性效应。结果报告如下。
1 材料与方法 1.1 材料(1)菌株与细胞株:幽门螺杆菌野生株MELHp27(Hp27)为本教研室从郑州市慢性萎缩性胃炎患者体内分离并保种(cagA+); cagA基因缺失突变株MEL -Hp27 ∆ cagA为本室自行构建, cagA基因被完全敲除掉, 代之以卡那抗性基因; 低分化胃癌细胞株BGC823细胞由郑州大学第一附属医院周慧聪博士惠赠。(2)试剂与仪器:四甲基偶氮噻唑蓝(MTT) (华美生物工程公司); FTTC-Annexin V/ PI标记液(北京宝赛生物技术有限公司); 紫外分光光度计(日本HITACHI公司)。酶标仪(美国BioRad公司); 流式细胞仪(美国Becton Dickinson公司)。
1.2 方法 1.2.1 Hp的培养将野生株MEL-Hp27和突变株MEL -Hp27∆ cagA分别接种于含10%羊血的布氏平板培养基(含万古霉素10 mg/ L、多粘菌素B 2 500 U/ L、TMP 5 mg / L、两性霉素5 mg / L), 37 ℃、微需氧条件下(10% CO2, 5% O2, 85%N2)培养, 3 d后收集细菌, 用PBS制成细菌悬液, 在分光光度计上测定细菌浓度(1A660=1×108CFU/ ml), 然后用含10%胎牛血清的无抗生素RPMI-1640培养液调整适当浓度用于攻击细胞。
1.2.2 BGC823细胞培养BGC823细胞的培养基为含10%胎牛血清的无抗生素RPMI -1640培养液, 细胞置于37 ℃含5%CO2的培养箱中常规培养。11213 BGC823细胞与Hp共培养BGC823细胞于37 ℃含5%CO2的培养箱中培养, 24 h后换用含Hp的细菌悬液, 置于37 ℃微需氧环境中共培养; 对照组只含10%胎牛血清的无抗生素RPMI-1640培养液; 野生株组和突变株组细菌与细胞的比例均为100:1。
1.2.4 细胞形态学观察BGC823细胞以1×104个/孔接种于24孔板中, 分别于细菌与细胞共同培养的6, 12, 24, 48 h对细胞形态进行观察。
1.2.5 细胞增殖测定采用MTT法, 细胞以5×103/孔密度接种于96孔板上, 每组设6个复孔, 分别在细菌与细胞共培养的12, 24, 48 h于每孔加入MTT 20 Ll, 置37 ℃、5% CO2培养箱继续培养4 h后, 弃孔内培养上清液, 每孔加入DMSO 150 μl, 室温避光摇床上充分振荡10 min, 在酶标仪上测定各孔A 492 nm吸光度(A)值并记录结果。
1.2.6 细胞凋亡测定细胞以5×105 /孔的密度接种于6孔板上, 置于37 ℃含5%CO2的培养箱中培养, 24 h后换用含Hp (5×107 /孔)的细菌悬液, 置于CO2培养箱中共培养。在细胞与细菌共培养48 h后, 胰酶消化细胞, 1 000 r/ min离心10 min, 收集细胞, 冷PBS洗3遍, 以FTTC-AnnexinV/ PI双标记后, 流式细胞仪检测, 该方法能区别凋亡细胞和坏死(PI标记)细胞。
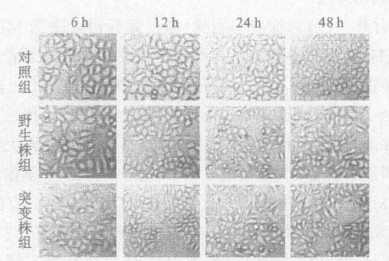
2 结果 2.1 细胞形态学(图 1)
|
图 1 Hp与细胞共培养各时间点细胞形态学变化 |
图 1可见, 人胃癌细胞BGC823株经野生株和突变株Hp攻击后, 均出现明显的形态学变化, 并随Hp与细胞共培养时间的延长, 细胞形态学变化越明显。对照组细胞贴壁生长良好, 轮廓清晰, 呈多边形, 胞质内颗粒较少。而野生株和突变株Hp攻击细胞6 h, 即可见细胞周边有较多细菌附着, 细胞有脱壁现象, 培养液中可见细胞崩解后的残留颗粒或菌体; 培养48h后, 可见细胞形态呈分散及蜂鸟样改变(细胞拉伸)。
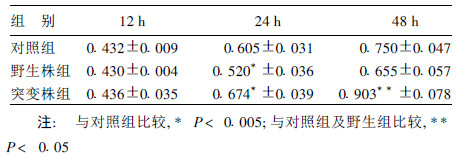
2.2 细胞增殖活性(表 1)| 表 1 Hp与BGC823细胞共培养不同时间点的MTT值( x ± s, n=6) |
表 1可见, 在Hp与细胞共培养的12 h, 野生株和突变株组细胞的增殖活性与对照组相比差别不大; 培养24 h时各组细胞增值活性差异有统计学意义(F=55.431, P=0.000), 其中突变株组细胞增值活性明显高于野生株组(P=0.000)和对照组(P=0.000), 野生株组细胞增值受抑制, 明显低于对照组(P=0.000);培养48 h时各组细胞增值活性差异仍有统计学意义(F=7.228, P=0.003), 两两比较显示, 突变株组细胞增值活性高于野生株组(P=0.001)和对照组(P=0.042)。
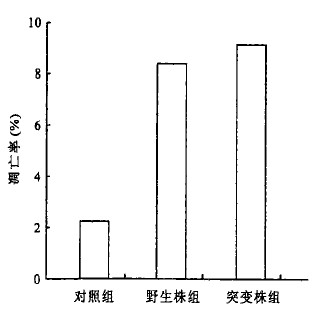
2.3 细胞凋亡率(图 2)
|
图 2 各组凋亡率比较 |
以100: 1的细菌与细胞比例共培养48 h后, 流式细胞仪分析显示, 野生株组和突变株组细胞凋亡率分别为8.43%和9.13%, 均高于对照组凋亡率2.73% (P < 0.05), 但2组差异无统计学意义。
3 讨论由于Hp菌株自身的变异, cagA阳性株与cagA阴性株间除cagA基因外存在许多差异, 在自然状态下很难对cagA基因功能做出真实判断。为此, 本室自行构建了幽门螺杆菌中国株cagA基因缺失突变株, 并在此基础上观察了遗传背景相同的野生株与突变株对人胃癌细胞株BGC823细胞增殖和凋亡的影响, 以期揭示cagA基因细胞水平的毒性效应。
本研究结果发现, 在Hp与细胞共培养6h即可观察到细胞形态学的改变, 在培养48h后, 均可导致细胞的分散或蜂鸟样改变(细胞拉伸), 与Stefan等〔5〕的报道相似。但是未发现野生株与cagA基因缺失突变株对细胞形态学的影响存在差异, 可见, cagA基因缺失仍然可以造成与野生株作用相似的细胞形态学变化, 提示Stein等〔6〕报道的cagA基因引起的细胞分散和蜂鸟样改变的效应可能并不是cagA基因所特有的作用。野生株与突变株虽然可以引起相似的细胞形态学变化, 二者的作用机制也可能不同。
本研究结果显示, 野生株对BGC823细胞具有抑制作用, 而缺失cagA基因的突变株却可刺激细胞增殖, 且在24, 48 h 2个时间点上都高于对照组和野生株组。由此可见, cagA基因在Hp抑制细胞增殖过程中发挥重要作用, 甚至是必需的元素。至于cagA基因缺失后Hp为何促进细胞增殖, 还有待于进一步研究。
细胞凋亡在维持胃肠道粘膜组织的完整性中起着非常重要的作用, 细胞凋亡与增殖之间的动态平衡是上皮细胞更新循环、维持稳态的重要途径〔7〕。佘菲菲等〔8〕在细胞内表达CagA蛋白, 并研究了cagA和凋亡的关系, 认为CagA可以诱导胃上皮细胞凋亡。但由于是通过载体在细胞内表达CagA蛋白, 与Hp在自然情况下攻击细胞的情形不同, 且只能分析cagA本身在细胞内的作用, 不能全面揭示与cagA相关的生物学功能, 因此, 对cagA基因功能的评价并不完全。本研究结果显示, 野生株和cagA基因缺失突变株在与细胞共培养48 h后均可引起细胞凋亡, 但2组凋亡率之间差异无统计学意义, 提示cagA基因在Hp诱导细胞凋亡的过程中作用有限, cagA基因有无对Hp致凋亡效应的影响并不大, 即CagA可能不是Hp诱导细胞凋亡的关键因子。
本实验利用细胞与细菌共同培养技术建立了体外Hp急性感染的细胞模型, 并且比较了中国幽门螺杆菌野生株与cagA基因同源缺失突变株对胃癌细胞株BGC823细胞的影响, 进一步丰富了有关中国幽门螺杆菌cagA基因功能的研究内容。本研究发现, Hp作用后细胞呈分散和蜂鸟样改变(伸长)并不是cagA基因特有的细胞学效应; cagA基因是Hp抑制细胞增值所必需的元素; cagA基因在Hp致细胞凋亡的效应中作用可能有限。
| [1] | Radosz-Komoniewska H, Bek T, Jozwiak J. Pathogenicity of Hel-icobacter pylori infection[J]. Clin Microbiol Infect, 2005, 11(8) : 602–610. DOI:10.1111/j.1469-0691.2005.01207.x |
| [2] | Rugge M, Busatto G, Cassaro M, et al. Patients younger than 40 years with gastric carcinoma Helicobacter pylori genotype and associated gastrit is phenotype[J]. Cancer, 1999, 85(12) : 2506–2511. DOI:10.1002/(ISSN)1097-0142 |
| [3] | Nomura M, Lee J, Stemmermann GN, et al. Helicobacter pylori CagA seropositivity and gas tric carcinoma risk in a Japanese American population[J]. J Infect Dis, 2002, 186(8) : 1138–1144. DOI:10.1086/jid.2002.186.issue-8 |
| [4] | Hsu PI, Hwang IR, Cittelly D, et al. Clinical presentation in relation to diversity within the Helicobacter pylori cag pathogenicity island[J]. Am J Gastroenterol, 2002, 97(9) : 2231–2238. DOI:10.1111/j.1572-0241.2002.05977.x |
| [5] | Stefan M, Matthias S, Terry K, et al. Helicobacter pylori induces AGS cell motility and elon-gation via independent signaling pathways[J]. Infect Immun, 2004, 72(6) : 3646–3649. DOI:10.1128/IAI.72.6.3646-3649.2004 |
| [6] | Stein M, Bagnoli F, Halenbeck R, et al. c-Src/Lyn kinases activate Helicobacter pylori CagA through tyrosine phosphorylation of the EPIYA motifs[J]. Mol Microbiol, 2002, 43(4) : 971–980. DOI:10.1046/j.1365-2958.2002.02781.x |
| [7] | 郑国华, 李颢, 李会庆. 大蒜油和白藜芦醇联合应用诱导胃癌细胞凋亡[J]. 中国公共卫生, 2005, 21(10) : 1205–1207. |
| [8] | 佘菲菲, 张静, 陈月秀, 等. 幽门螺杆菌cagA基因稳定转染胃上皮细胞及其对细胞的作用[J]. 中国人兽共患病杂志, 2006, 22(1) : 29–32. |
 2007, Vol. 23
2007, Vol. 23