众所周知,食物消化和吸收的主要器官是胃肠,它在进食、消化和营养物质吸收等方面起着十分重要的调控作用。而这些功能的有效发挥作用有赖于健全、协调的胃肠道动力的存在〔1〕。胃肠动力不仅调节营养素消化和吸收的速率,而且还参与食欲和饱腹感的调节〔2〕,并且通过神经系统来将各种信号传导到大脑的相应区域,这种传感方式很大程度上影响了摄食行为和总能量的平衡。有研究已经观察到肥胖病人胃肠动力的改变〔3〕,这些改变可能是肥胖发生发展过程中的作用因素之一。本文旨在从胃肠动力来探讨肥胖和肥胖抵抗机制。
1 材料与方法 1.1 饮食诱导肥胖与肥胖抵抗动物模型的建立健康雄性SD大鼠,120只,体重(180±10)g (上海斯莱克实验动物有限公司),大鼠单笼饲养,自由饮水和摄食,每日记录给食量和撒食量,每周称量体重1次。动物给予高脂饲料2周后,根据体重增加量排序,位于体重增加量中间的1/4鼠(30只)作为正常对照组,转成基础饲料饲养。其余鼠继续喂饲高脂饲料,在第8周时,按照体重增加量再次排序,位于体重增加量的上1/3鼠(30只)筛选为肥胖鼠,下1/3鼠(30只)筛选为肥胖抵抗鼠,中间1/3鼠(30只)剔除。
1.2 饲料配方参照美国官方分析化学师协会(AOAC)与美国营养协会(AIN)提供的啮齿类动物配方。其中基础饲料每100 g含有脂肪5 g (其中豆油2.5 g,猪油2.5 g),高脂饲料每100 g含有脂肪15 g (其中豆油2.5 g,猪油12.5 g)。基础饲料脂肪供热比为11.2%;高脂饲料脂肪供热比为29.9%。
1.3 方法每组随机抽取10只大鼠,进行72 h代谢实验,采用微量凯氏定氮法〔4〕与索氏提取法〔5〕分别测定饲料和粪便中的蛋白质和脂肪含量,样品回收率为95%~105%。此外,每组随机抽取10只大鼠进行胃排空实验,其余大鼠进行小肠推进功能实验。
1.3.1 胃排空的测定将浓度为1 mg/ml的酚红溶液按10 ml/(kg·bw)灌胃,30 min后处死动物。取胃内容物溶入0.15 mol/LNaOH溶液中,静止1 h。然后从中取5 ml上清液加入1 ml三氯乙酸溶液混合离心,离心后取4 ml上清液加入1 ml NaOH溶液,在721分光光度计上读取560 nm处吸光度值。胃排空率(%)=(1-胃内酚红含量/灌胃酚红含量)×100%。
1.3.2 小肠推进率测定将炭墨溶液按照10 ml/(kg·bw)灌胃,20 min后处死动物,打开腹腔,分离肠系膜,剪取上端至幽门,下端至回盲肠的肠管,放于托盘上,轻轻将小肠拉成直线,测量肠管长度作为小肠总长度,从幽门至墨汁前沿的距离作为炭墨在肠内推进距离。炭墨推进百分率(%)=炭墨在肠内推进距离(cm)/小肠全长(cm)×100% (炭墨溶液由10%阿拉伯胶和10%的活性炭配制而成)。
1.4 统计分析采用SPSS软件进行描述性及方差分析等。
2 结果 2.1 肥胖易感(OP)和肥胖抵抗(OR)大鼠体重比较基础组、OP组与OR组大鼠实验前体重分别为(193.2±7.11),(192.9±5.69),(194.3±10.05) g,各组动物实验前体重比较差异无统计学意义(P > 0.05)。从第1周开始随时间推移,各组大鼠体重差异逐渐增加,第8周时,基础组、OP组、OR组大鼠体重分别为(459.98±28.90),(512.23±36.90),(432.92±22.55) g,组间比较差异有统计学意义(P > 0.05)。
2.2 OP和OR大鼠蛋白质消化吸收的比较OP组大鼠、基础组大鼠蛋白质摄入量显著高于OR组大鼠,3组大鼠的粪氮含量与尿氮含量比较差异均无统计学意义。OP组大鼠、基础组大鼠蛋白质吸收量要显著高于OR组大鼠,而3组大鼠蛋白质利用量比较差异无统计学意义,见表 1。
| 表 1 肥胖和肥胖抵抗大鼠蛋白质消化吸收的比较( x±s,n=10) |
2.3 OP和OR大鼠脂肪消化吸收的比较
OP组大鼠脂肪摄入量显著高于OR组大鼠与基础组大鼠,OP组大鼠脂肪排出量显著高于基础组大鼠,与OR组大鼠比较差异无统计学意义。OP组大鼠脂肪吸收量显著高于OR组大鼠与基础组大鼠,见表 2。
| 表 2 肥胖和肥胖抵抗大鼠脂肪消化吸收的比较( x±s,n=10) |
2.4 OP和OR大鼠胃排空率的比较
OP组、OR组与基础大鼠胃排空率分别为(86.06±11.90)%,(82.10±18.81)%,(90.22±7.71)%,3组大鼠胃排空率比较差异无统计学意义,但有OP组大鼠胃排空率高于OR组大鼠的趋势。
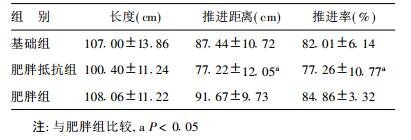
2.5 OP和OR大鼠小肠推进功能的比较OP组大鼠的小肠推进距离与推进率与OR组大鼠比较差异有统计学意义(P < 0.05),见表 3。
| 表 3 肥胖和肥胖抵抗大鼠脂肪消化吸收的比较( x±s,n=10) |
3 讨论
胃肠在肥胖与肥胖抵抗的发生中发挥着重要作用,尤其是小肠作为消化系统最关键的一个部位,可以能动性的改变营养素的吸收〔6〕。研究提示,胃肠的不同部位之间能够形成一个复杂而又精密的联合通路来对食物的摄入以及营养素的消化吸收进行调节〔7〕。
参考Levin〔8〕报道,我们建立了高脂饮食诱导的OP大鼠和OR大鼠动物模型。对于营养素的研究,本实验主要观察了蛋白质和脂肪的摄入、吸收情况。结果表明,OP组大鼠蛋白质摄入量与吸收量显著高于OR组大鼠,但在蛋白质利用方面2组差异无统计学意义。这可能是蛋白质在满足大鼠生理需要后,剩余蛋白质并不会在体内贮存而是随排泄物排出体外。因而大鼠发生肥胖和肥胖抵抗可能主要取决于脂肪。脂肪消化吸收的研究结果显示,OR组大鼠脂肪摄入量要显著低于OP组大鼠,但脂肪排出量却与OP组大鼠基本相同,2组大鼠在脂肪吸收量方面存在一定差异,这种差异可能是导致肥胖不同易感性的原因之一。
本研究结果显示,OP组与OR组大鼠胃排空率比较差异无统计学意义,与以往的研究结果一致〔9, 10〕。但研究还发现,OP组与OR组大鼠胃排空率有低于基础对照组的趋势,这种情况的产生可能是由于OP组与OR组大鼠脂肪摄入量较多,导致胆囊收缩素的大量释放,使胃的排空减慢〔11〕。小肠推进功能比较的结果显示,OP组大鼠的小肠推进距离以及推进率显著高于OR组大鼠,表明OP组大鼠小肠功能要优于OR组大鼠,因此,OP组大鼠的小肠营养素吸收会更加迅速和有效率。胃肠动力方面的差异控制着摄入的营养素的推进和吸收,影响着动物的饱食感,改变着OP与OR组大鼠的摄食行为。这种差异可能是肥胖与肥胖抵抗发生发展过程中的潜在的决定因素,因此,胃肠动力差异有待进一步研究。
| [1] | Ying Sun, Jinade Chen. Intestinal electric stimulation decrease fatabsoption in rats: Therapeutic potential for obesity[J]. Obesity Re-search, 2004, 12(8) : 1235–1242. DOI:10.1038/oby.2004.157 |
| [2] | Moo-In Park, Michael Camilleri. Gastric motor and sensory func-tion in obesity[J]. Obes Res, 2005, 13 : 491–500. DOI:10.1038/oby.2005.51 |
| [3] | Mathus-vliegen EMH, Vanierl ML, Roolker W, et al. Gastricempting, CCK release, and satiety in w eight-stable obese subject[J]. Digestive Diseases and Sciences, 2005, 50(1) : 7–14. DOI:10.1007/s10620-005-1269-x |
| [4] | 中华人民共和国标准.食品中蛋白质的测定方法[S]. GB/T1477-93.北京:中国标准出版社, 1994. |
| [5] | 潘能斌. 食品中脂肪含量测定方法的改进[J]. 中国卫生检验杂志, 2006, 16(7) : 884. |
| [6] | Eisenbraun J, Ehrlein HJ. Effects of somatostatin on luminal transit and absorption of nutrients in the proximal gut of minipigs[J]. Dig Dis Sci, 1996, 41 : 894–901. DOI:10.1007/BF02091528 |
| [7] | Jinhong Xing, Jiande DZ Chen. Alterations of gastrointestinal Motility in obesity[J]. Obes Res, 2004, 12 : 1723–1732. DOI:10.1038/oby.2004.213 |
| [8] | Levin BE, Triscari J, Sullivan AC. M etabolic features of diet in-duced obesity w ithout hyperphagia in young rats[J]. Am J physiol, 1986, 251 : 433–440. |
| [9] | Verdich C, MMadsen JL, Toubro S, et al. Effect of obesity and majorweight reduction on gastric empting[J]. Int J Obes Relat Metab Disord, 2000, 24 : 899–905. DOI:10.1038/sj.ijo.0801250 |
| [10] | Zurakow ski A, Zahorska-Markiew icz B, Nalew ajka-Kolodziejczak J, et al. Evaluation of gastric motility in obesity[J]. Pol Merkuriusz Lek, 2003, 13(85) : 65–68. |
| [11] | Read N, French S, Cunningham K. The role of the gut in regulating food intake in man[J]. Nutr Rev, 1994, 52 : 1–10. |
 2007, Vol. 23
2007, Vol. 23

 , 蔺威鸣, 袁超, 王国秀
, 蔺威鸣, 袁超, 王国秀