2. 广西医科大学医学科学实验中心;
3. 广西医科大学公共卫生学院
患者血清中某些小分子蛋白标志物可以用于疾病监测和快速诊断, 但分离分子量 < 10 000 Da的小分子蛋白质面临很多问题。三(羟甲基)甲基甘氨酸聚丙烯酰胺凝胶电泳(Tricine-SDS-PA GE)是目前一种有效分离小分子蛋白、多肽的电泳方法, 可以用于分离小至1 kDa的小分子肽〔1〕。但其分离效果与样品处理、样品中目的蛋白含量以及染色方法等密切相关。文献报道, 使用Tricine-SDS-PA GE分离小分子蛋白的样品多为蛋白质标准品〔1-3〕。作者在分离小分子肽的实验中发现, 根据文献报道的方法, 对于分离蛋白标准品或高丰度蛋白效果尚可, 但直接用于分离人血清中低丰度的小分子蛋白效果并不理想。因此, 作者在样品的处理、染色等方面进行改进, 建立了一种效果理想、简便灵敏的分离人血清中小分子蛋白质的方法。结果报告如下。
1 材料与方法 1.1 材料 1.1.1 试剂与仪器磷酸二氢钠、磷酸氢二钠、氯化钠、尿素、丙烯酰铵、N, N′ -甲叉双丙烯酰铵、过硫酸铵、盐酸、氢氧化钠、甘油、溴酚蓝、三氯乙酸(TCA)、甲醇、戊二醛、醋酸、考马斯亮蓝G250、低分子量蛋白质标准品、三羟甲基氨基甲烷(Tris)、三羟甲基甲基甘氨酸(Tricine)、二硫苏糖醇(DTT)、3 -[(3 -胆酰胺丙基) -二乙胺] -丙磺酸(CHAPS)、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED) (上海生工生物工程有限责任公司); A KTA Purifier -900层析系统、Hitrap Blue层析柱(美国Amersham Biosciences公司); Power Pac HCTW电泳仪、Mini Protean 3well垂直电泳槽(美国Bio -Rad公司); 摇床(江苏海门市其林贝尔仪器制造有限公司)。
1.1.2 样品样品取自广西医科大学第一附属医院经病理诊断的肝细胞癌患者血清。
1.2 方法 1.2.1 溶液配制(1)层析缓冲液配制:结合缓冲液为390 ml的20 mmol NaH2PO4和610 ml的20 mmol Na2HPO4溶液混合成1000 ml的磷酸盐缓冲液, 用HCl调pH值至7.0。用配制好的结合缓冲液配500 ml的2 mol NaCl磷酸盐洗脱缓冲液。(2)凝胶贮存液配制:A贮液为49.5 %丙烯酰铵总浓度, 3 %交联度的丙烯酰铵贮存液:称取48 g丙烯酰铵和1.5 g N, N′ -甲叉双丙烯酰铵, 溶于100 ml双蒸水, 溶液混匀后经滤纸过滤。B贮液为49.5 %丙烯酰铵总浓度, 6 %交联度的丙烯酰铵贮存液:称取46.5 g丙烯酰铵和3 g N, N′ -甲叉双丙烯酰铵溶于100 ml双蒸水, 溶液混匀后经滤纸过滤。胶缓冲液为3 mol Tris, 0.3 g/ L SDS用HCl调pH值至8.45。(3)蛋白质电泳溶液配制:阳极缓冲液为0.2 mol Tris, 用HCl调pH值至8.9, 阴极缓冲液为0.1 mol Tris, 0.1 mol Tricine, 0.3 g/ L SDS用HCl调pH值至8.25。(4)样品缓冲液配制: 3 mol Tris (pH 8.45), 2.4 ml甘油, 0.8 g SDS, 0.3 mol DTT, 少许溴酚蓝, 定容至10 ml。
1.2.2 层析柱去除白蛋白冻融血清, 4 ℃, 12 000 r/ min, 离心5 min, 取上清液1 ml, 用9 ml结合缓冲液按1: 9比例稀释上样于Hitrap Blue层析注, 在A KTA Purifier2900层析系统上进行层析分离, 用磷酸盐洗脱缓冲液以流速2 ml/ min进行洗脱。在层析过程中, A KTA Purifier2900层析系统自动收集未与层析柱结合部分的溶液和洗脱液(1 ml/管), 并绘出280 nm波长处的吸光度(A 280 nm)曲线。
1.2.3 胶的制备按文献〔2〕分别配制分离胶、间隙胶和浓缩胶, 依次灌胶。
1.2.4 样品处理将样品1 (未与层析柱结合部分的溶液)和样品2 (洗脱液), 分别倒入3 000 Da的超滤离心管, 4 ℃, 12 000 r/ min, 离心浓缩2 h, 浓缩体积至1 ml。分别加入到含2 ml U9缓冲液(9 mol Urea, 2 %CHAPS, 1 %DTT)的离心管, 400~600 r/ min冰浴振荡30 min。取样品1、2分别与样品缓冲液等体积混匀, 60 ℃水浴加热5 min。
1.2.5 电泳条件内槽装阴极缓冲液, 外槽用阳极缓冲液恒压电泳, 先40 V约1.5 h, 当样品进入分离胶时, 电压升至60 V约1.5 h。
1.2.6 染色和脱色电泳结束时, 用双蒸水把胶面洗净。分别采用方法1 :置于新鲜配制的5 %戊二醛溶液中固定, 50~60 r/ min, 振荡1 h。然后用双蒸水洗净胶面, 用含0.025 %考马斯亮蓝G250的10 %醋酸溶液染色, 50~60 r/ min, 振荡1 h, 最后转至10 %醋酸溶液脱色, 直到背景清晰。方法2 :置于染色液(0.1 %甲醇, 0.5 % TCA, 0.1 %考马斯亮蓝G250)中, 50~60 r/ min, 振荡染色1 h。然后用双蒸水洗净胶面, 转至双蒸水脱色, 1 h。更换双蒸水2~3次, 直到背景清晰。
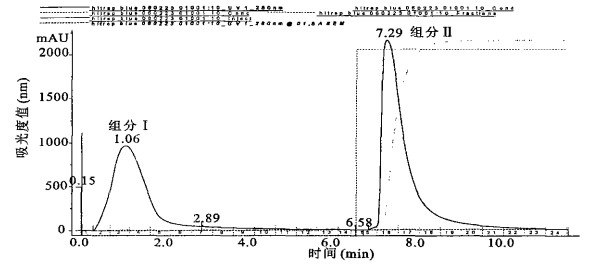
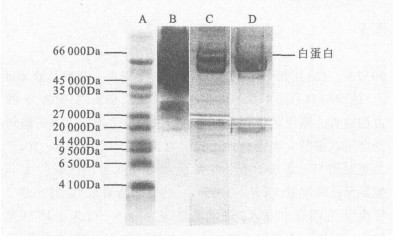
2 结果 2.1 层析柱去除血清白蛋白前后的比较(图 1, 图 2)血清经Hitrap Blue层析柱分离后, 得到2个吸收峰, 分别命名为组分Ⅰ、组分Ⅱ。组分Ⅰ为未与层析柱结合的蛋白质, 组分Ⅱ为白蛋白洗脱液。组分Ⅰ、Ⅱ与血清原样的电泳结果比较显示, 血清原样白蛋白污染严重, 组分Ⅰ经去除白蛋白后, 白蛋白污染显著减少, 电泳可分离出10 000 Da以下的小分子蛋白质。
|
图 1 经Hitrap Blue层析柱分离的各组分 |
|
A :低分子量蛋白质标准品; B :血清原样; C :组分Ⅰ; D :组分Ⅱ 图 2 不同组分电泳结果比较 |
2.2 样品用U9处理前后比较(图 3)
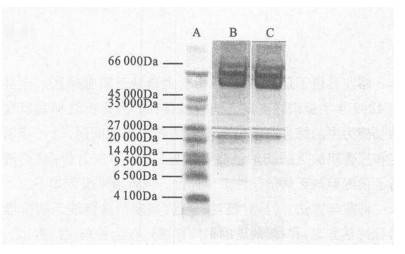
组分Ⅰ用U9处理前后的凝胶图显示, 未用U9处理的样品, 分离10 000 Da以下的小分子蛋白效果不佳; 用U9处理后的样品, 10 000 Da以下的小分子蛋白清晰可见。
|
A :低分子量蛋白质标准品; B :用U9处理后的样品; C :未用U9处理样品 图 3 样品用U9处理前后的比较 |
2.3 不同染色方法比较(图 4)
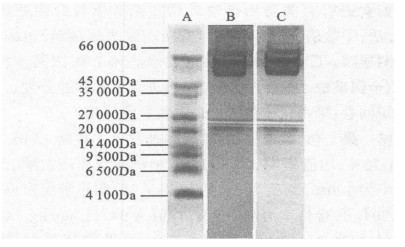
相同样本凝胶分别用方法1和方法2进行考马斯亮蓝染色。结果显示, 用方法1染色, 凝胶背景颜色深, 分离10 000 Da以下的小分子蛋白效果不佳; 用方法2染色, 凝胶背景颜色浅, 10 000 Da以下的小分子蛋白清晰可见。
|
A :低分子量蛋白质标准品; B :方法1;C :方法2 图 4 不同染色方法的比较 |
3 讨论
本实验采用的Tricine-SDS-PA GE方法与目前国内外采用的相似, 可有效分离小分子蛋白和多肽〔1-3〕。但用此法直接分离未经任何处理的人血清时效果不佳, 可能与血清中小分子目的蛋白的含量太低有关。利用Hitrap Blue层析柱去除白蛋白后, 不仅可以增加电泳样品的上样量, 还可分辨出10 000 Da以下的小分子蛋白质或多肽。本实验还发现, 样品经含尿素、CHAPS和DTT的U9处理后, 有助于分离小分子蛋白。U9可以断裂蛋白质间的氢键和二硫键, 使疏水相互作用被取消, 多肽被去折叠, 从而提高电泳中蛋白的分辨率〔5, 6〕。
此外, 快速的固定、染色和脱色对于提高小分子多肽电泳的分辨率也是必要的, 这主要是由于小分子多肽对染料的结合力较弱, 易扩散冲洗掉而着色较差〔2〕。传统的染色方法多采用甲醛、甲醇〔7〕、戊二醛〔8〕、乙酸和乙醇〔9〕等进行固定、染色和脱色, 但小分子多肽有时很难被固定, 且染色背景较深, 脱色时间长, 大大降低了分辨率和灵敏度。本实验应用经过改良的染色液配方, 用 < 1 %浓度的三氯乙酸代替高浓度的乙酸, 甲醇浓度也只有0.1 %, 染色和脱色时间相对较短, 使染色液检测灵敏度提高, 可以检测10 ng/条带的蛋白质。而且染色过程中由于背景颜色很浅, 可以随时看到染色的进度。脱色过程简便易行, 只需用水, 不需要用缓冲液反复冲洗脱色。但如果用水冲洗, 能得到透明无色背景, 可以进一步提高检测灵敏度。
| [1] | 曹佐武. 有效分离1 KDa小肽的Tricine-SDS-PAGE方法[J]. 中国生物工程杂志, 2004, 24(1) : 74–76. |
| [2] | 石继红, 赵永同, 王俊楼, 等. SDS-聚丙烯酰胺凝胶电泳分析小分子多肽[J]. 第四军医大学学报, 2000, 21(6) : 761–763. |
| [3] | Schagger H, von Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamid gel electroporesis for the separation of proteins in the range from 1 to 100 kDa[J]. Analytical Biochemistry, 1987, 166(2) : 368–397. DOI:10.1016/0003-2697(87)90587-2 |
| [4] | Steel L F, Trotter M G, Nakajima PB, et al. Efficient and specific removal of albumin from human serum samples[J]. Molecular &Cellular Proteomics, 2003, 2(4) : 262–270. |
| [5] | 张群业, 黄秋花, 沈树红, 等. 1人APL细胞株NB4不同二维电泳条件对电泳结果的影响[J]. 中国实验血液学杂志, 2004, 12(4) : 401–405. |
| [6] | Lanne B, Potthast F, Hoglund A, et al. Thiourea enhances mapping of the proteome from murine white adipose tissue[J]. Proteomics, 2001, 1(7) : 819–828. DOI:10.1002/(ISSN)1615-9861 |
| [7] | 练玉银, 刘志刚, 温岸玲. 鲤鱼主要变应原的分离、鉴定与纯化[J]. 中国公共卫生, 2006, 22(8) : 947–949. |
| [8] | 李志红, 赵永芳. 一种鉴定胸腺素高活性小分子组分的灵敏简便方法[J]. 武汉大学学报, 1998, 44(2) : 252–254. |
| [9] | 康彬, 童哲. 一种利于蛋白质回收的快速SDS-聚丙烯酰胺凝胶电泳染色-脱色方法[J]. 生物化学与生物物理进展, 2000, 27(2) : 210–211. |
 2007, Vol. 23
2007, Vol. 23

