2. 中国人民解放军第43医院;
3. 第三军医大学研究生处
鱼藤酮(Rotenone)是典型的线粒体抑制类农药, 广泛应用于农业生产中。研究证实, 长期接触该类化合物可导致中枢多巴胺神经元损伤, 动物产生类似帕金森病的症状, 但其具体作用机制尚不完全清楚〔1, 2〕。星型胶质细胞(A stroglia)是中枢神经系统数量最多、分布最广的胶质细胞, 在神经系统发育、突触传递、神经组织修复与再生、神经免疫以及多种神经疾病的的病理机制等方面都起着十分重要的作用。在病理条件下, 功能改变的星型胶质细胞可能是帕金森病等神经退行性疾病发生、发展的始动因素或促进因素〔3〕。本研究以原代培养星型胶质细胞为试验对象, 观察体外鱼藤酮染毒对星型胶质细的毒性效应特点, 以期为探讨神经退行性疾病的发病机制提供依据。
1 材料与方法 1.1 主要试剂和仪器鱼藤酮(美国Sigma公司); 胎牛血清培养基(DM EM / F12) (美国Gibco公司); 类标准胎牛血清(兰州民海生物公司); T ripure (美国Roche公司); 乳酸脱氢酶试剂盒(南京建成生物公司); 四甲基偶氮噻唑蓝(M T T) (美国A mersco公司)。酶标仪(美国BIO-RAD公司); PCR仪(德国Eppendor f公司); 荧光显微镜E600(日本尼康公司)。
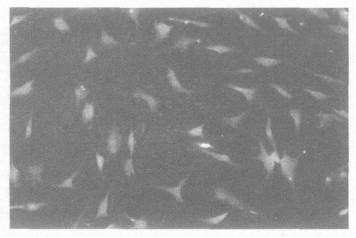
1.2 星型胶质细胞原代培养、纯化和鉴定生后3 d SD新生大鼠(第三军医大学大坪医院动物所); 断头取中脑组织, 按照文献〔4〕方法分离和纯化星型胶质细胞, 经3次传代后即可得纯化的星型胶质细胞。星型胶质细胞鉴定采用免疫荧光法检测胶质纤维酸性蛋白(GFA P)表达。一抗为兔抗鼠GF AP (1:100)抗体, 二抗为异硫氰酸荧光素(FIT C)标记的羊抗兔I gG (1:50), 荧火显微镜下, 以490 nm波长的激发光观察, GF AP阳性细胞即为星型胶质细胞。
1.3 染毒星型胶质细胞形态观察将制备的细胞悬液接种于24孔培养板中, 用含有20%胎牛血清的培养液培养5 d, 待细胞基本长满孔壁后, 换成含0.0, 0.1, 0.5和1.0 Lmol/ L鱼藤酮的培养液。各设2个平行孔, 培养24 h后, 观察鱼藤酮对星型胶质细胞的影响, 摄像记录。
1.4 M T T法检测星型胶质细胞活力将制备的细胞悬液接种于96孔培养板中, 接种密度为5.0×104/ ml。待细胞基本长满孔壁后, 换成含0.0, 0.1, 0.25, 0.5, 0.75, 1.0和2.0 μmol/ L鱼藤酮的培养液200 μl。每组设6个平行孔, 培养24 h后每孔加入20 μl M T T继续培养4 h, 然后各孔加入150 μl二甲基亚砜溶解紫色结晶, 于酶标仪上测定波长490 nm的吸光度(A)值, 吸光度值的大小反映胶质细胞成活数量及活性。
1.5 乳酸脱氢酶(L DH)释放量测定鱼藤酮染毒浓度分别为0.0, 0.1, 0.25, 0.5, 0.75, 1.0和2.0 μmol/ L, 星型胶质细胞L DH释放量测定按试剂盒说明书操作。
1.6 生长曲线分析鱼藤酮对细胞增殖的影响细胞接种于24孔板中, 分别加入含0.0, 0.1, 0.5和1.0 μmol/ L鱼藤酮的培养液1 ml, 接种密度为5.0×104/ ml, 每组设4个平行孔。起始日为当天接种细胞, 次日起, 即开始检测每孔中的细胞总数, 用计数板计数, 连续观察5 d, 取4个孔的平均值绘制生长曲线。
1.7 RT-PCR检测缝隙连接蛋白CX43 mR NA表达PCR引物参照文献〔5〕设计, 由上海英骏生物技术公司合成, 设磷酸甘油脱氢酶(GA PDH)阳性产物作为PCR内参照。CX43和GA PDH扩增片段长度分别为291和542 bp, 引物序列如下: CX43: 5'-TACCACGCCACCACTGGCCCA-3'; 5'-CATTCTGGTTGTCGTCGGGGAA-3', GA PDH: 5'-GACCTGACTGACTACCTCAT-3'; 5'-TCGTCATACTCCTGCTTGCT-3'。逆转录反应体系包括4 μg RNA、oligo (dT) 15、R NA酶抑制剂、dN T Ps、5×RT缓冲液和鼠原白血病逆转录酶(M-M L V), 反应体积为20 μl。采取CX43和GA PDH同管扩增的方法, P CR循环参数为: 95℃预变性5 min后进入循环, 95℃变性30 s, 60℃复性30 s, 72℃延伸45 s, 循环30次, 最后72℃额外延伸10 min。每一个样品采用3管平行扩增, 并且重复1次。
1.8 统计分析采用SPSS 10.0软件进行方差分析和t检验。
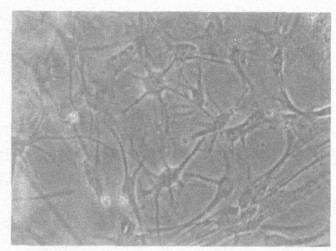
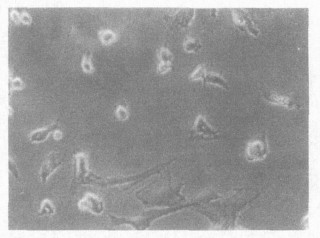
2 结果 2.1 鱼藤酮对星型胶质细胞形态的影响(图 1~3)正常星型胶质细胞为扁平梭形或星形, 有细长突起, 胞浆丰富, 胞核较大, 境界清楚, 有1~2个核仁, 位于核中央; 免疫荧光法染色显示培养的星型胶质细胞阳性率达95%以上。0.1 μmol/ L鱼藤酮染毒细胞形态未见明显改变; 0.5 μmol/ L鱼藤酮染毒24 h可引起明显的细胞形态变化, 细胞胞体折光增强, 细胞间隙增大, 有少量细胞圆缩肿胀或脱壁; 随着染毒剂量的增大, 损伤程度明显加重, 胞浆内出现中毒颗粒, 细胞数量明显减少。
|
图 1 正常星型胶质细胞形态(×100) |
|
图 2 原代星型胶质细胞GFAP荧光染色(×100) |
|
图 3 鱼藤酮染毒星型胶质细胞形态(×100) |
2.2 不同浓度鱼藤酮对星型胶质细胞活力的影响(表 1)
鱼藤酮浓度越高则细胞活力越低。与正常对照组比较, 0.1, 0.25, 0.5μmol/ L鱼藤酮染毒星型胶质细胞活力未见明显降低, 而0.75, 1.0和2.0 μmol/ L鱼藤酮染毒星型胶质细胞活力分别下降7.0% (P < 0.05), 11.3% (P < 0.01)和20.1%(P < 0.01)。
| 表 1 鱼藤酮染毒星型胶质细胞活力与LDH释放量的变化(n=6, x±s) |
2.3 鱼藤酮对星型胶质细胞L DH释放的影响
鱼藤酮呈浓度依赖性增加LDH释放量, 降代细胞活力, 当浓度低于0.75 μmol/ L时, 对细胞损伤较小, 当浓度达到0.75 μmol/ L以上时, LDH释放量显著增加(P < 0.01), 细胞膜完整性受损, 细胞活力明显降低。
2.4 鱼藤酮对星型胶质细胞增殖的影响随着鱼藤酮染毒浓度的增加, 细胞增殖受到抑制; 0.5 μmol/ L鱼藤酮染毒2 d后, 细胞增殖明显被抑制; 1.0 μmol/ L鱼藤酮染毒1 d后细胞数量即显著低于正常对照组(P < 0.01)。
2.5 鱼藤酮对星型胶质细胞CX43 mRN A表达影响(图 4)0.1 μmol/ L鱼藤酮对星型胶质细胞CX43 mRNA表达未见明显影响; 而0.5和1.0 μmol/ L鱼藤酮染毒引起CX43 mRNA的表达分别降低7.8% (P < 0.05)和9.1% (P < 0.05)。
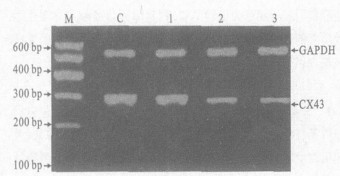
|
C:对照组; 1: 0.1 μmol/ L鱼藤酮组; 2: 0.5 μmol/ L鱼藤酮组; 3: 1.0 μm ol/ L鱼藤酮组; M: marker 图 4 鱼藤酮染毒星型胶质细胞缝隙连接蛋白CX43表达的变化 |
3 讨论
本实验结果表明, 0.1μmol/ L鱼藤酮染毒时, 体外星型胶质细胞的形态改变并不明显, 当染毒浓度达到0.5 μmol/ L以上时细胞出现圆缩肿胀或脱壁, 细胞数量减少。另外, 鱼藤酮染毒浓度越高, 星型胶质细胞活力越低, L DH释放量越高, 并存在明显的剂量依赖关系。但0.1, 0.25, 0.5 μmol/ L鱼藤酮染毒时星型胶质细胞活力并未显著下降, LDH释放量增加亦不明显。结果显示, 引起细胞活力改变的最小暴露剂量高于引起细胞形态改变的最低剂量, 说明体外培养细胞对毒物很敏感, 细胞容易脱壁, 虽然细胞形态有明显改变, 但细胞仍具活力。此外, 本室以往研究发现, 0.25μmo l/ L鱼藤酮染毒即可引起多巴胺PC12细胞活力显著降低〔6〕, 提示星型胶质细胞作为脑内可增殖的细胞之一, 区别于神经元, 其对鱼藤酮耐受性较强。
与神经元比较, 星型胶质细胞在体外增殖较快。研究表明, 脑外伤或神经变性疾病可导致体内胶质细胞反应性增生, 此时星型胶质细胞数量增加, 具有更多的胶质丝和突起, 代谢活动也增强, 进而影响神经递质的代谢和神经元的功能活动。体外实验发现, 0.1 μmo l/ L鱼藤酮染毒时星型胶质细胞增殖未产生明显变化, 但0.5 μmol/ L鱼藤酮染毒第2 d即可发现细胞增殖受到明显抑制, 随中毒时间的延长, 鱼藤酮对星型胶质细胞体外增殖的抑制愈发显著。胶质细胞间缝隙连接蛋白CX43是星型胶质细胞行使其功能活动的重要结构基础, 也是与细胞增殖分化密切相关的结构。星型胶质细胞无动作电位, 细胞间也无突触连接, 细胞间信息传递(如钙波的传导), 神经递质的摄取与运输及其他物质的代谢, 主要通过以CX43为基础的缝隙连接来完成172。本实验结果表明, 0.1 μmol/ L鱼藤酮染毒时CX43 mR NA表达上调, 但与正常对照组相关并不显著, 0.5和1.0 μmol/ L鱼藤酮引起CX43表达不同程度的显著降低。说明鱼藤酮中毒对细胞间缝隙连接和细胞通讯产生明显影响, 细胞增殖也受到抑制, 从而干扰胶质细胞之间以及胶质细胞与神经元之间的递质代谢。
综上所述, 体外原代培养的星型胶质细胞对鱼藤酮等化学毒物更加敏感, 体外细胞形态和增殖分化的观察与体内的组织病理改变有着明显的不同。但与神经元比较, 星型胶质细胞对相同剂量的鱼藤酮染毒具有更强的耐受能力。
| [1] | 董兆君. 鱼藤酮的多巴胺神经元毒性和帕金森病[J]. 国外医学:神经病学与神经外科学杂志, 2001, 82(5) : 357–360. |
| [2] | He Y, Imam S Z, Dong ZJ, et al. Role of nitric oxide in rotenone-induced nigro-striatal injury[J]. J Neurochem, 2003, 86(6) : 1338–1345. DOI:10.1046/j.1471-4159.2003.01938.x |
| [3] | Przedborski S, James E, Goldman. Pathogenic role of glial cells in Parkinson. s disease[J]. Advances in molecular and cell biology, 2003, 31(3) : 967–982. |
| [4] | Mc Carthy KD, De Vellis J. Preparation of separate astroglial and oligodendro glial cell cultures from rat cerebral tissue[J]. J Cell B-iol, 1980, 85 : 890–902. DOI:10.1083/jcb.85.3.890 |
| [5] | Cecile V, Catherine L, Claude K. Selective patterns of expression of G protein during in vitro development of hypothalamic neurons[J]. J Neurochem, 1994, 63(6) : 2231–2239. |
| [6] | 吴强, 杨和平, 林海, 等. 鱼藤酮长期作用对海马NO和脂质过氧化影响[J]. 中国公共卫生, 2005, 21(6) : 714–715. |
| [7] | HTanigami A, Rebel LJ, Martin TY, et al. Effect of glutam ine synth etase inhibition on astrocyte sw elling and altered astroglial protein expression during hyperammonem ia in rats[J]. Neuroscience, 2005, 131(4) : 437–439. |
 2007, Vol. 23
2007, Vol. 23