2. 中国疾病预防控制中心传染病预防控制所
霍乱弧菌(VC)的溶源性噬菌体(CTXφ)与新类型霍乱病原菌的产生密切相关, CTXφ基因组包括RS区和核心区。RS区依次包括ig1间隔区、rstR、ig2间隔区、rstA、rstB和rstC基因。其中主要变异基因为抑制子基因(rstR)及ig2, 国外已报道了3种类型, 分别发现于O1群霍乱弧菌古典生物型(CVC)、埃尔托生物型(EVC)和O139群VC, GenBank序列号分别为VCU83796、AF 055890、AF 110029, 本文暂时命名为古典型(class)、埃尔托型(ET)和加尔各答型(calc)〔1-5〕。核心区依次包括cep、orfU、ace、zot和ctxAB基因, 核心区不携带ctxAB基因的CTXφ称为nct-CTXφ。本课题在研究我国EVC的CTXφ和nct-CTXφ基因组分布特征时, 发现1种新类型rstR-ig2基因, 暂命名为new ET类型, 还发现不同类型rstR-ig2基因的CTXφ和nct-CTXφ基因组共存的新类型。现将结果报告如下。
1 材料与方法 1.1 材料 1.1.1 菌株霍乱弧菌EVC (中国疾病预防控制中心), 其中携带rstR-ig2基因的类型及菌株数分别为class 10株, ET10株, class和ET共存10株, class和newET共存4株。对共存类型利用ctxAB和zot基因探针Southern杂交, zot基因的拷贝数均多于ctxAB, 表明这些菌株同时携带不同rstR-ig2类型的CTXφ和nct-CTXφ基因组。
1.1.2 主要试剂和仪器Taq DNA聚合酶、dNTP、限制性核酸内切酶(中国华美生物工程公司); Gene Amp PCR system 9600型PCR扩增仪(美国PE公司); GDS 7 500型凝胶成像仪(英国UVP公司)。
1.2 方法 1.2.1 引物设计利用Oligo 610软件进行引物设计, 引物在上海生工公司合成。扩增片断分别为:(1)上游引物CTRS上5'-ATT GAC AGG ATG AAG GAT ACC-3', 下游引物rstA下5'-CGG AAT TCT CGA CAT CAA AT G GCA TG -3', 用于扩增CTXφ基因组串联体的第1个基因组末端和第2个起始端之间的基因, 扩增片断简称为CR, 约1 500bp, 片段包括ctxB 3c端部分基因、ig1、rstR、ig2和rstA 5c端部分基因。(2)上游引物ZCT上5'-GCT ACA AGG TGC TAC CGTTAC-3', 和引物rstA下配对, 用于扩增nct-CTXφ基因组串联体的第一个基因组末端和第2个起始端之间的基因, 扩增片断简称为ZR, 约1 500 bp, 包括zot 3c端部分基因、ig1、rstR、ig2和rstA5c端部分基因。对CR和ZR扩增产物进行酶切鉴定, 内切酶选用RsaⅠ和BglⅡ。(3)上游引物TLC上5'-CTT GGA T TA AGT CAA CCA GAG-3', 和引物rstA下配对, 扩增片断简称为TR, 约210 kb, 包括TLC基因簇3 c端部分基因、ig1、rstR、ig2和rstA5c端部分基因。对扩增产物进行酶切鉴定, 内切酶选用RsaⅠ和BglⅡ。(4) ctxAB基因分段扩增:利用ZCT上和ZCT下5'-GTG TGT TGT GGT ATTCTG CAC-3', 引物CTB上5'-GGT GTA AAA TT C CTTGAC G-3'和CTB下5'-GCT TCT CAT CAT CGA ACC-3'扩增, 扩增片段分别约1 000和550 bp。(5) tcpA基因扩增:引物tcpA上为5'-AGA ACA CGA TAA GAA AAC CG-3'和tcpA下5'-AAC GCT GGA TTT GAG ATG AC -3', 扩增片段约900 bp。
1.2.2 PCR扩增及酶切PCR反应体积50Ll, 1×PCR缓冲液, 100 Lmol dNTP, 0.5 Lmol引物, 1.0 U Taq DNA聚合酶, 模板约100 ng (采用SDS裂解-酚氯仿抽提-乙醇沉淀方法制备)。PCR扩增的循环参数为: 94℃ 5 min; 94℃ 15 s, 60℃ 15 s, 72℃ 30 s~2 min, 30个循环; 72℃ 5 min。扩增产物在1.0%的琼脂糖凝胶上(含0.5 Lg/ml溴乙锭)电泳, 长波紫外线下观察并将PCR产物条带割下, 利用试剂盒回收凝胶中PCR产物, 回收的PCR产物直接作为测序模板。直接对PCR产物进行酶切, 按内切酶试剂盒说明书操作, 酶切产物同上电泳, 紫外灯下观察并拍照。
1.2.3 PCR产物测序及序列分析提供PCR扩增产物和扩增用引物作为测序引物, 由上海博亚公司测序, 对PCR产物直接测序。序列拼接及生物信息学分析应用DNAStar软件分析, 网上同源比较应用http://www1ncbi1nlm1nih1gov网站BLASTn序列分析软件。
2 结果 2.1 CR和ZR基因扩增产物酶切及测序结果(图 1, 图 2)
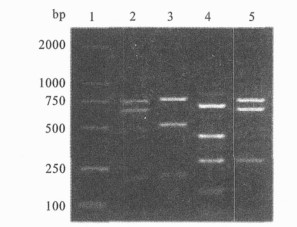
|
图 1 ZR和CR的PCR产物RsaⅠ酶切图谱 |
图 1可见, 扩增双拷贝nct-CTXφ基因组的ZR产物经酶切分析共分为2种类型, 经测序表明rstR-ig2分别为class和newET类型, 测序菌株分别为86 015株和JX94 484株。扩增双拷贝CTXφ基因组的CR产物经酶切分析共分为2种类型, 经测序表明rstR-ig2分别为ET和class类型, 测序菌株分别为S 2株和S 73株。
图 2可见, ZR和CR扩增产物测序结果表明: CTXφ和nct-CTXφ基因组zot基因3c末端60bp序列中40%位点不同, 推测的氨基酸序列中60%位点不同; nct-CTXφ基因组在zot基因终止密码子后12 bp处为ER序列, 其后为ig1序列, 无CTXφ基因组zot和ctxA基因之间的序列; class、ET和newET类型ig1、rstR和ig2基因序列同源性分别为77.0%~97.4%, 10.4%~17.9%, 9.6%~64.8%, rstR推测的氨基酸序列同源性为9.2%~24.1%。
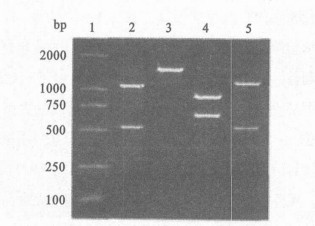
|
图 2 ZR和CR的PCR产物BglⅡ酶切图谱 |
2.2 TR基因扩增、酶切及测序(图 3)
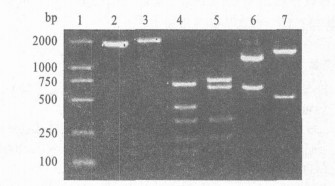
|
图 3 TR基因PCR扩增及酶切图谱 |
携带CTXφ和/或nct-CTXφ基因组的EVC, TR基因扩增均阳性, 经RsaI和BgÓ酶切共分为2个类型。测序表明, rstR-ig2基因分别为ET和class类型, 测序菌株分别为SC 8 511和SC 9 773。
2.3 ctxAB基因测序结果对SC 9 773株、SC 8 511、SC 94118株和SC 9 8107株的ctxAB基因分段扩增及测序, 测序结果与标准菌株N 16 961的ctxA和ctxB基因的同源性分别> 99%和98%, 推测的氨基酸序列的同源性分别> 98%和96%。
2.4 tcpA基因测序结果对SD 86 015、SC 9 773株、SC 8511、SC94 118株和SC 98 107株的tcpA基因测序, tcpA基因及推测的TcpA氨基酸序列, 与GenBank中查询到的EVC和O139群产毒株的同源性均> 99%。
2.5 GenBank收录基因序列号本研究被GenBank收录的基因序列号分别为: AF 511 006, AF 511 007, AF 511 008, AF521 415, AF 12 401, AF 510 996, AF 510 994, AF 510 995, AF516 343, AF 511 000, AF 510 999, AF 511 003。
3 讨论将上述研究结果与本课题组已完成的分子流行病学资料〔6〕结合分析。结果表明, 不同rstR-ig2类型(以上标形式表示)的CTXφ和/或nct-CTXφ基因组及代表菌株分别为:携带nct-CTXclassφ基因组的SD 86 015株、携带CTXclassφ基因组的SC 9 773株、携带CT XETφ基因组的SC 8 511、同时携带nct-CTXclassφ和CTXETφ基因组的SC 94 118株、同时携带nct-CTXnewETφ和CTXclassφ基因组的SC 98 107株, 后2种共存类型为国内外首次发现〔7, 8〕。tcpA基因编码的TcpA组装的TCP菌毛是CTXφ感染霍乱弧菌的受体, 本研究发现共存类型的tcpA基因序列同EVC标准菌株N 16 961株均100%同源, 提示nct-CTXclassφ、CT XETφ、nct-CTXnewETφ和CTXclassφ均可能以该类型TCP菌毛为受体而感染霍乱弧菌〔9〕。
对CTXφ和/或nct-CTXφ基因组在染色体插入位点附近序列分析显示, CTXETφ和CTXclassφ基因组均与TLC基因簇相邻, 除SD 86 015株nct-CTXclassφ基因组与TLC基因簇相邻, 其他菌株的nct-CTXclassφ和nct-CTXnewETφ附近染色体序列均不是TLC基因簇, 是何种基因有待进一步研究〔5〕。
RS区的ig2间隔区包括rstR基因的启动子和rstA的操纵区, RstR与rstA的操纵区结合并抑制rstA基因表达, RstR是rstA型特异性抑制子, 也决定了噬菌体免疫性, 即携带某一类型rstR基因的VC不再感染同类型的CTXφ或nct-CTXφ。class、ET和newET类型rstR-ig2基因及RstR序列同源性均非常低, 这也是不同rstR-ig2类型nct-CTXφ和CTXφ基因组共存于同一菌株的理论基础。霍乱弧菌只要携带CTXφ基因组即可产生霍乱毒素, 导致霍乱样腹泻, 为什么部分菌株同时携带不同rstR-ig2类型的nct-CTXφ基因组, 共存的意义也有待进一步研究〔3〕。
| [1] | Sack DA, Sack RB, Nair GB, et al. Cholera[J]. Lancet, 2004, 363(9404) : 223–233. DOI:10.1016/S0140-6736(03)15328-7 |
| [2] | Liu G, Yan M, Liang W, et al. Resistance of the cholera vaccine candidate IEM108 against CTXPhi infection[J]. Vaccine, 2006, 24(11) : 1749–1755. DOI:10.1016/j.vaccine.2005.09.059 |
| [3] | Jensen MA, Faruque SM, Mekalanos JJ, et al. Modeling the role of bacteriophage in the control of cholera outbreaks[J]. Proc Natl Acad Sci USA, 2006, 103(12) : 4652–4657. DOI:10.1073/pnas.0600166103 |
| [4] | McLeod SM, Kimsey HH, Davis BM, et al. CT Xphi and Vibrio cholerae: exploring a newly recognized type of phage-host cell relationship[J]. Mol Microbiol, 2005, 57(2) : 347–356. DOI:10.1111/j.1365-2958.2005.04676.x |
| [5] | Bhattacharya T, Chatterjee S, Maiti D, et al. Molecular analysis of the rstR and orfU genes of the CTX prophages integrated in the small chromosomes of environmental vibrio cholerae non-O1, non -O139 strains[J]. Environ Microbiol, 2006, 8(3) : 526–634. DOI:10.1111/emi.2006.8.issue-3 |
| [6] | 芮勇宇, 阚飙, 高守一, 等. 霍乱弧菌CT XU基因组抑制子基因多态性分析[J]. 中国预防医学杂志, 2003, 12(4增刊) : 211–213. |
| [7] | Sen A, Ghosh AN. New Vibrio cholerae O1 biotype ElT or bacteriophages[J]. J Virol, 2005, 2 : 28. DOI:10.1186/1743-422X-2-28 |
| [8] | Nusrin S, Khan GY, Bhuiyan NA, et al. Diverse CTX phages among toxigenic vibrio cholerae O1 and O139 strains isolated between 1994 and 2002 in an area where cholera is endemic in Bangladesh[J]. J Clin Microbiol, 2004, 42(12) : 5854–5856. DOI:10.1128/JCM.42.12.5854-5856.2004 |
| [9] | Asaduzzaman M, Ryan ET, John M, et al. The major subunit of the toxin-coregulated pilus TcpA induces mucosal and systemic immunoglobulin A immune responses in patients with cholera caused by vibrio cholerae O1 and O139[J]. Infect Immun, 2004, 72(8) : 4448–4454. DOI:10.1128/IAI.72.8.4448-4454.2004 |
 2007, Vol. 23
2007, Vol. 23
