2. 浙江天元生物药业公司;
3. 浙江大学医学院附属第一医院
自2003年12月~2006年10月16日, 世界各地共发生由禽传人的H5N1禽流感病例256人, 死亡151人, 病死率高达59 % 〔1〕。由于流感病毒极易变异, 一旦获得在人间传播的能力, 数亿人的生命将受到威胁, 其潜在危害性远超过严重急性呼吸道综合征(SARS), 已引起WHO和世界各国政府的重视〔2〕, 并把人用禽流感疫苗的研究提到重要位置〔3〕。2005年我们从国外引进2株H5N1亚型禽流感病毒, 用于疫苗的研究, 由于内容较多, 现把研究结果分3部分:(1)疫苗毒种的检定及毒种库的建立; (2)疫苗检定评价; (3)疫苗免疫动物的效果观察。本文报告第一部分。
1 材料与方法 1.1 材料(1)毒种: NIBRG-14株(简称R1194)(英国国家生物制品检定所)。该毒株是1194株(A/Viet Nam/1194/2004 H5N1)和PR8株(H1N1)2病毒, 通过反相遗传的方法改造而成; VNH5N1-PR8/CDC-RG株(简称R1203)(美国疾病控制中心), 该毒株是用1203株(A/VietNam/1203/2004H5N1)和PR8株(H1N1)病毒, 通过反相遗传的方法改造而成。2种病毒均在胚蛋中传二代(P2)。(2)血清:禽流感病毒H5血凝素及抗血清(英国国家生物制品检定所); A1、A3、B型人流感病毒血凝素及抗血清(英国国家生物制品检定所); R1203抗血清(本实验室用R1203疫苗免疫家兔获得)。(3)无致病菌(SPF)鸡蛋(北京实验动物中心SPF鸡群)。
1.2 方法(1)血凝抑制试验和单向免疫扩散试验:按常规法。(2)病毒滴度测定:按常规鸡胚感染法, 每稀释度接种4只胚蛋。(3)无菌试验和外源因子检查:按现行版《中国药典》的要求测定〔4〕。(4)毒种免疫源性测定:病毒经灭活、浓缩、纯化后, 用不同剂量的血凝素经大腿肌肉接种210~215 kg家兔4只, 14 d后加强1针, 首针后28 d采血, 测定血凝抑制抗体和中种抗体。(5)血凝素序列测定:根据H5的核酸序列, 设计一对特异性引物, 经RT-PCR扩增H5基因, 通过T-A克隆, 将其插入载体, 转导大肠埃希菌, 筛选阳克隆, 提取质粒, 由上海生物工程研究所进行测序。(6) R1194和R1203的原始株序列:来源于美国国家生物信息中心基因库(NCBIGenBank)〔5, 6〕。(7)电子显微镜图片:由浙江医学科学院电镜室协助拍摄。
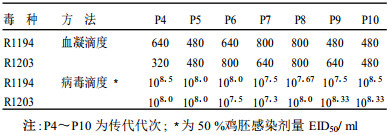
2 结果 2.1 病毒滴度测定毒种接种胚蛋20只, 经培养后, 将血凝阳性的尿囊液混合测得的血凝滴度和病毒滴度见表 1。
| 表 1 传代的病毒滴度 |
从表 1可见, 2个毒种适应在胚蛋中增殖, 均有较高的血凝滴度和病毒滴度, 并能稳定传代。
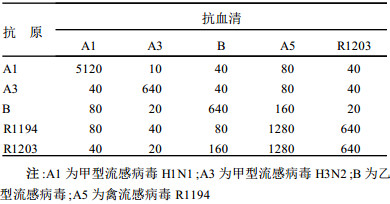
2.2 血凝抑制试验用R1194, R1203, A1, A3, B型的抗原与它们的抗血清作交叉血凝抑制试验, 见表 2。
| 表 2 各型流感病毒交叉血凝抑制试验(倒数) |
从表 2可见, 抗血清对同型的抗原有较高的血凝抑制滴度, 对其他型别也有一定的交叉, 交叉滴度大都在≥1:40。
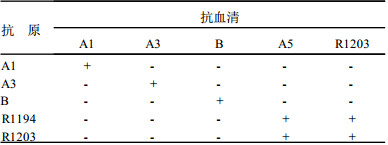
2.3 单向免疫扩散试验用R1194, R1203, A1, A3, B型流感病毒的抗原(含量约60 μg HA/ml左右)与它们的抗血清作交叉单扩试验结果见表 3。
| 表 3 各型流感病毒交叉单向免疫扩散试验 |
从表 3可见, 各型抗血清仅对同型抗原起反应, 对其他型别无交叉。
2.4 2毒株H5血凝素(HA)序列测定与原始株的比较 2.4.1 R1194(P5) HA测得的核苷酸序列(图 1)
|
图 1 R1194(P5) HA核苷酸序列 |
2.4.2 R1194株与原始毒株不同核苷酸序列部位(图 2)
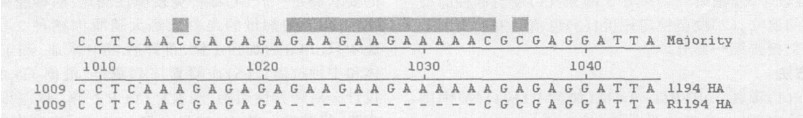
|
图 2 R1194株与原始毒株不同核苷酸序列 |
从图可知:R1194株(P5)的核苷酸序列与原始毒株比较, 去了1022~1033的12个碱基(4个氨基酸), 在1015, 1034和1036位置上的A由C取代。
2.4.3 R1194株与原始毒株不同氨基酸序列部位(图 3)
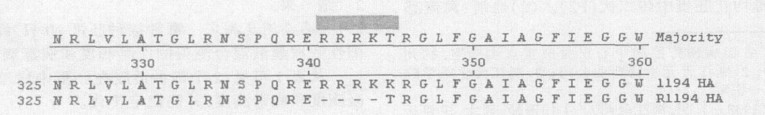
|
图 3 R1194株与原始毒株不同氨基酸序列 |
从图 3可知, R1194株(P5)的氨基酸序列与原始毒株比较, 去了RRRK 4个氨基酸, 下一个K由T取代, 现已知含有R-R-R-K-K-R氨基酸序列的禽流感毒株属高致病力毒株〔7〕。
2.4.4 R1203(P5) HA测得的核苷酸序列(图 4)
|
图 4 R1203(P5) HA核苷酸序列 |
2.4.5 R1203株核苷酸序列与原始株比较后的不同部位(图 5)
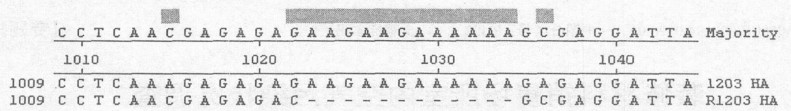
|
图 5 R1203株与原始株不同核苷酸序列 |
从图 5可知, R1203株(P5)的核苷酸序列与原始毒株比较, 与R1194(P5)株完全一样。
2.4.6 R1203株与原始毒株不同氨基酸序列部位(图 6)
|
图 6 R1203株与原始毒株不同氨基酸序列 |
从图可知:R1203株(P5)的氨基酸序列与原始毒株比较, 也与R1194(P5)株一样。
2.4.7 序列同源性R1194(P5)与R1203(P5)的核苷酸序列同源性为99.1%;R1194(P5)与R1194(P10)的氨基酸序列完全相同; R1203(P5)与R1203(P10)仅2个氨基酸不同。
2.5 无菌试验和外源因子检查符合现行版《中国药典》的要求。
2.6 毒种免疫源性测定R1194(P5), R1203(P5)2毒株, 各制成15μg HA/0.5 ml, 免疫家兔4只, 2针(隔14 d), 首针后28 d, 测得血清中的中和抗体滴度均≥1:40。
2.7 电子显微镜观察R1194(P5), R1203(P5)2毒株的尿囊培养液, 经浓缩、纯化的电镜照片均可看见完整的病毒颗粒。
2.8 毒种库的建立根据现行版《中国药典》三部通则中“生物制品生产和检定用菌毒种管理规程” 〔4〕的要求, 将R1194和R1203毒种建立了三级种子库; 即原代、主代和工作代。(1)原代:引进的毒种P2作为原代。(2)主代:原代在胚蛋中传2代P4作为主代。(3)工作代:主代在胚蛋中传1代P5作为工作代。
3 讨论据报道, 禽用禽流感疫苗的研究已取得突破性进展〔8〕, 基本解决禽类的预防问题, 已规模生产。但人用禽流感疫苗的研究仍在进行中。据国际制药企业协会联合会(IFPMA)2006年5月的统计〔9〕, 全球H5N1禽流感疫苗人体观察的地区有法、美、英、德、日、澳、俄、比利时、(中国未列入)等, 并取得较大的进展〔10-13〕。所用的毒种有NIBRG-14, NIBRG -4, VI1203, US-NIAID, A/H.K./492/1997等, 其中也包括本研究的2株。一旦H5N1禽流感病毒获得由人传人的能力, 此疫苗的需求量必然极大, 目前国际上任何一家流感疫苗生产厂都不可能满足供应, 因而凡生产普通流感疫苗的厂家, 必须做好生产禽流感疫苗的技术贮备, 以供急需〔14〕。
本文引进的2株H5N1亚型禽流感病毒, 经序列测定表明, 均已去除毒性基因, 即血凝素基因中表达R-R-R-K-K-R的氨基酸序列, 事实上, 仅去除有毒基因的H5N1毒株尚不能用于疫苗生产, 还必须适应在胚蛋中增殖的能力, 才能用于制造疫苗, 故还需将去除毒性基因的毒株通过反向遗传技术, 将减毒株的HA和NA基因及胚蛋适应株A/PR/8的其他6个基因和它的4个复制酶基因分别克隆到质粒上, 共同转染Vero细胞, 获得遗传重配的病毒株。研究表明, 经过减毒的重配株R1194和R1103均能在胚蛋中大量增殖。
经对2种减毒株检定时发现, 在血凝仰制试验中, 普通流感病毒A1, A3, B型与H5N1禽流感病毒之间均有一定的交叉反应, ,滴度大都在≥1:40, 这不能表示普通流感病毒和H5N1病毒的抗体, 具有相互保护的能力, 从单扩试验表明, 它们之间没有交叉; 经中和试验也证明它们之间没有相互中和的能力。因而判断禽流感疫苗的质量, 不能仅靠血凝抑制试验的结果来决定疫苗接种后的免疫效果, 更重要的是观察中和抗体的产生和它的效价。
(参加此项研究的还有:谢荣辉, 赵芝雅, 金美珍, 丁云龙, 李枫, 黎丹, 袁勇等。)
| [1] | Cumulative number of confirmed human cases of avian influenza A/(H5N1) reported to WHO 13 November 2006[EB/OL].http://www.WHO.int/csr/disease/avia-influenze/country/cas2es-table-2006-10-16/en/indx.html. |
| [2] | 世界卫生组织.关于大流行流感必须知道的10件事(2005-10-14)[R/EB].http://www.WHO.int/csr/disease/influenze/pandemic10things/zh/print.html. |
| [3] | WHO.大流行流感疫苗法规指南[EB/OL ].http//www.nicpbp.org.cn/SHW/nicpbp.nsf/svdocs/562711c41db727ee4825. |
| [4] | 国家药典委员会.生物制品生产和检定用菌种、毒种管理规程[M].《中华人民共和国药典》三部.北京:化学工业出版社, 2005:3. |
| [5] | 美国国家生物信息中心基因库(NCBI GenBank)[EB].登录号: A Y651333. |
| [6] | 美国国家生物信息中心基因库(NCBI GenBank)[EB].登录号: A Y818135. |
| [7] | 黄庾明, 辛朝安. 禽流感病毒血凝素(HA)基因的研究进展[J]. 广东畜兽医科技, 2001, 26(2) : 3–5. |
| [8] | 霍惠玲, 王增利, 高丰, 等. 禽流感疫苗研究进展[J]. 动物医学进展, 2005, 26(5) : 25–27. |
| [9] | R & D for avian/pandemic influenza vaccines by IFPMA influenza vaccine supply international task force (IVS ITF) members[EB].(Updated 1 May 2006).IFPMA (WWW.ifpma.org). |
| [9] | |
| [10] | John J, Treanor M D, James D, et al. Safety and immunogenicity of an inactivated subvirion influenza A (H5N1) vaccine[J]. N Engl J Med, 2006, 354(13) : 1343–1351. DOI:10.1056/NEJMoa055778 |
| [11] | Bresson JL, Perronne C, Launay O, et al. Safety and immunogenicity of an inactivated split-virion ifluenza A/Vietnam/1194/2004(H5N1) vaccine:phase Ⅰ randomised trial[J]. Lancet, 2006, 367(9523) : 1657–1664. DOI:10.1016/S0140-6736(06)68656-X |
| [12] | 英国葛兰素史克流感疫苗临床试验成功[EB/OL].http://in2fo.pharmacy.hc360.com/2006/04/07101739167.shtml. |
| [13] | Lin J, Zhang j, Dong x, et al. Safety and immunogenicity of an inactivated adjuvanted whole-virion influenza A (H5N1) vaccine: a phase I randomised controlled trial[J]. Lancet, 2006, 368(9540) : 991–997. DOI:10.1016/S0140-6736(06)69294-5 |
| [14] | 郭元吉. 禽流感的十大热点问题[J]. 科学, 2006(1) : 24–29. |
 2007, Vol. 23
2007, Vol. 23