锰是一种较常见的职业毒物。近年来, 随着现代工业的发展, 锰的生产和消费日益增多, 锰与生殖健康的关系逐渐引起人们的重视〔1〕。有研究表明, 若机体摄入过量的锰, 会导致睾丸组织发生病理学改变, 性功能障碍及睾丸组织生化酶学的改变〔2〕。本实验采用氯化锰染毒小鼠, 动态观察小鼠睾丸脏器系数; 检测小鼠染锰56 d生育指数及生殖指标的变化; 定量组织学分析生精上皮细胞数的变化, 以探讨锰对雄性小鼠生殖毒性的剂量-效应关系。
1 材料与方法 1.1 动物6~8周雄性昆明种小鼠140只, 体重23~28g (贵阳医学院实验动物中心), 均为普通级动物, 合格证号为scxk 2002-0001。普通饲料饲养。
1.2 主要试剂及仪器MnCl2·4H2O (分析纯, 中国医药集团上海化学试剂公司); 电子称(武汉自动化仪器厂); BI2000图像分析系统(成都泰盟公司产品)。
1.3 方法 1.3.1 动物分组雄性昆明种小鼠140只, 随机分成3个染锰组和1个对照组, 每组35只。
1.3.2 染锰方法3个染锰组分别给予腹腔注射氯化锰(7.5, 15.0和30.0 mg/kg)。对照组采用等容生理盐水腹腔注射, 每周5 d, 1次/d。每周测小鼠的体重1次, 以调整用药量。
1.3.3 标本收集分别于染锰3, 7, 14, 28, 56 d每组随机抽取5只小鼠, 脱臼法处死, 立即分离双侧睾丸, 生理盐水冲洗, 用滤纸吸干后称重, 用于测定睾丸脏器系数。取小鼠左侧睾丸迅速置于10%甲醛溶液内固定, 常规方法脱水, 石蜡包埋。
1.4 观察指标及方法 1.4.1 睾丸脏器系数睾丸称重后按照公式:睾丸脏器系数=睾丸重(g)/小鼠体重(g)×100%。
1.4.2 生殖实验于染锰第56 d, 将剩余各组小鼠(每组10只), 分别与未经处理的成熟雌性小鼠1:1合笼一周后, 取出雄鼠。雌鼠以合笼第1 d为妊娠0 d, 于妊娠第19 d处死, 计录妊娠母鼠数、活胎数、死胎数。计算:(1)雄鼠生育指数(使交配雌鼠受孕的雄鼠数/总交配的雄鼠数×100%); (2)每窝平均活胎数(活胎总数/受孕母鼠总数); (3)平均着床数(胎鼠总数/受孕母鼠总数); (4)总死胎数(死胎总数/胎鼠总数× 100%)〔3〕。
1.4.3 定量组织学分析取染锰56 d睾丸用苏木素-伊红(HE)染色, 每例切片一张, 在图象分析仪下每例测定10个曲细精管的横截面积及管内生精上皮细胞数量。
1.5 统计分析采用SPSS 11.0统计软件进行分析。用方差分析进行检验。生育指数、总死胎率采用χ2检验。
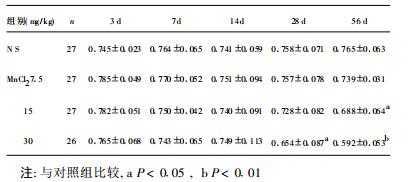
2 结果 2.1 染锰剂量与时间对小鼠睾丸脏器系数的影响(表 1)| 表 1 染锰剂量与时间对小鼠脏器系数的影响(%, x±s) |
由表 1可见, 于染锰第28 d, 30 mg/kg组脏器系数开始降低, 与对照组比较差异有统计学意义(P < 0.05);染锰第56 d, 15与30 mg/kg组睾丸脏器系数均与对照组比较差异有统计学意义(P < 0.05, P < 0.01)。
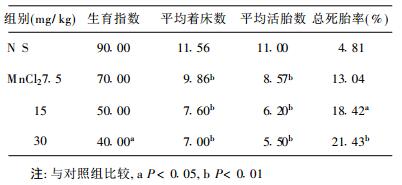
2.2 染锰对雄性小鼠生育能力的影响(表 2)| 表 2 染锰对雄性小鼠生殖能力的影响 |
染锰56 d, 7.5, 15 mg/kg组生育指数低于对照组, 但差异无统计学意义(P > 0.05);30 mg/kg组生育指数低于对照组(P < 0.05); 15, 30 mg/kg组总死胎率高于对照组(P < 0.05;P < 0.01)。
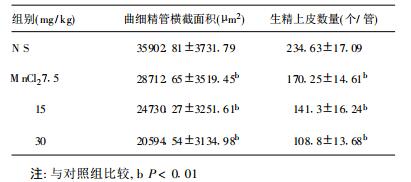
2.3 染锰对小鼠曲细精管横截面积及管内生精上皮细胞数量的影响(表 3)| 表 3 染锰56 d小鼠睾丸曲细精管横截面积和生精上皮细胞数量的变化( x±s, n=5) |
定量组织学分析结果表明, 染锰可使小鼠曲细精管横截面积明显减少, 管内发育各阶段的生精细胞数量降低。染锰56 d, 各染锰组与对照组比较, 其曲细精管横截面积及生精上皮细胞定量测定数值均明显减少(P < 0.01)。
3 讨论锰作为机体内某些代谢酶的组成部分或酶的激动剂, 参与了许多生物化学反应, 是机体必需的微量元素之一〔4〕。但过量的锰在体内蓄积, 会对机体产生不良作用。本实验发现, 随染锰剂量的增加和时间的延长, 小鼠睾丸重量下降, 睾丸脏器系数明显降低, 提示锰可通过血睾屏障, 损害睾丸的正常结构, 干扰精子的生长和发育过程〔5〕。有研究发现, 锰能使多巴胺(DA)和5-羟色胺(5-HT)含量减少, 从而降低了DA和5 -HT对垂体促性腺激素(LH、FSH)的抑制, 导致FSH和LH水平升高〔6〕。下丘脑血循环中性激素水平的负反馈调节作用而使睾酮浓度下降, 从而使精子数量减少。锰还可抑制乳酸脱氢酶(LDH), 阻碍精子能量来源, 干扰粗线期初级精母细胞的减数分裂及分化为精子的过程, 从而影响精子的数量和活力。锰最先抑制曲细精管生精上皮细胞的琥珀酸脱氢酶, 干扰曲细精管细胞的能量合成, 导致细胞代谢降低, 使曲细精管生精细胞、Sertoli细胞受损〔7〕。研究证实, 锰是一种较强的染色体断裂剂〔5〕。氯化锰可使生精细胞发生基因突变和染色体畸变, 从而导致小鼠精子畸形率升高。Gavin等认为锰可直接作用于线粒体呼吸链而影响线粒体的氧化磷酸化, 对线粒体功能具有抑制作用〔8〕。Galvani等〔9〕利用嗜镉细胞瘤(PCI2)细胞进行体外研究表明, MnCl2可抑制呼吸链中的还原型烟酰胺腺膘呤二核苷酸(NADH)脱氢酶和NADH细胞色素还原酶的活性。从而影响电子传递和线粒体的呼吸功能, 使三磷酸腺苷(ATP)生成减少, 影响生精细胞供能, 使精子活动度降低。精子数量减少、畸形率升高和精子活动度的降低, 可引起精子的运动能力和穿透卵细胞的能力下降, 使母鼠受孕率下降; 由于精子畸形和染色体畸变, 基因发生突变, 受精卵在植入后的发育过程中胚胎可在早期死亡或胚胎在发育过程中出现死亡, 因而死胎率增加。
| [1] | 才秀莲, 李兴升, 李季蓉, 等. 染锰鼠睾丸增殖细胞核抗原与热休克蛋白表达[J]. 中国公共卫生, 2005, 21(11) : 1331–1333. |
| [2] | 吴卫平, 胡万达, 纪淑琴. 锰的雄性生殖毒性[J]. 国外医学:卫生学分册, 1990, 17(6) : 324–327. |
| [3] | 吴鑫, 钟先玖, 范卫, 等. 丙烯腈对雄性大鼠生殖功能的影响[J]. 中华劳动卫生职业杂志, 2001, 9(5) : 357–359. |
| [4] | 苗健, 高琦, 许恩来. 微量元素与相关疾病[M]. 郑州: 河南医科大学出版社, 1997: 127-128. |
| [5] | 庄碧嘉, 陈月华, 曹易琼. 硫酸锰对雄性小鼠生殖系统的亚慢性毒性影响[J]. 卫生毒理学杂志, 1996, 10(2) : 97–99. |
| [6] | 姜岳明, 陆继培, 谢佩意, 等. 锰对接触男工性腺激素水平的影响[J]. 广西医科大学学报, 2000, 17(l) : 20–22. |
| [7] | 孙统达, 聂国本. 锰对男工的生殖毒性[J]. 劳动医学, 1995, 12(2) : 46–48. |
| [8] | Gavin CE, Gunter KK, Gunter TE. Mn2+ sequestration by mito-chondria and inhibition of oxidative phosphorylation[J]. Toxicol Appl Pharmacol, 1992, 115(1) : 1–5. DOI:10.1016/0041-008X(92)90360-5 |
| [9] | Galvani P, Fumagalli P, Santagostino A. Vulnerability of mitochon-drial complex I in PC12 cells exposed to manganese[J]. Eur J Phar-macol, 1995, 293(4) : 377–383. DOI:10.1016/0926-6917(95)90058-6 |
 2007, Vol. 23
2007, Vol. 23

 , 李兴升, 李季蓉, 张先平
, 李兴升, 李季蓉, 张先平